题目内容
20.实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法错误的是( )| A. | NaNO2是氧化剂 | |
| B. | NH4Cl中的氮元素被氧化 | |
| C. | 每生成1 mol N2转移的电子的物质的量为6 mol | |
| D. | N2既是氧化剂,又是还原剂 |
分析 由NaNO2+NH4Cl═NaCl+N2↑+2H2O可知,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由-3价升高为0,以此来解答.
解答 解:A.NaNO2中N元素的化合价,则为氧化剂,故A正确;
B.NH4Cl中的氮元素化合价升高,失去电子被氧化,故B正确;
C.每生成1 mol N2转移的电子的物质的量为3 mol,故C错误;
D.由反应可知,NaNO2是氧化剂,NH4Cl为还原剂,N2既是氧化产物,又是还原产物,故D错误;
故选CD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.根据如表实验现象所得结论正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 | 溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法正确的是( )
| A. | 元素的单质一定是由还原该元素的化合物来制得 | |
| B. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
5.下列叙述不正确的是( )
| A. | 氨易溶解于水,因此可用来作喷泉实验 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气 |
12.把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Mg2+的浓度为( )
| A. | $\frac{8b-3a}{2V}$mol•L-1 | B. | $\frac{8b-3a}{V}$mol•L-1 | C. | $\frac{a-2b}{V}$mol•L-1 | D. | $\frac{a-2b}{2V}$mol•L-1 |
9.碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失.为了鉴定其质量和确定田间施用量,必须测定其含氮量.
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
达滴定终点时的现象为溶液从无色变为浅红色,30s内不褪色,由此可计算出该样品中的氮的质量分数为14%.
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法.将样品放入圆底烧瓶中:

(1)请选择必要地装置,按气流方向连接顺序为b-e,f-h,g-c.
(2)分液漏斗中的液体最适合的是B.
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用防止空气中水和二氧化碳进入装置影响实验结果.
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量.甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4+2H2SO4+6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量.步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液.用酸式滴定管准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴酚酞指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值偏小(填“偏大”“偏小”或“无影响”).
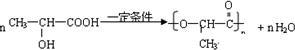
 是人体生理活动的一种代谢产物.以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.请回答相关问题:
是人体生理活动的一种代谢产物.以下是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.请回答相关问题: