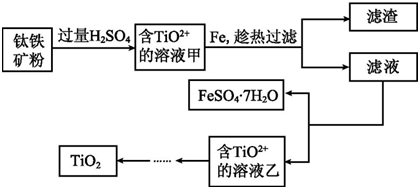
题目内容
14.常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明).A是天然有机高分子化合物,D是一种重要的化工原料.在相同条件下,G蒸气密度是氢气的44 倍.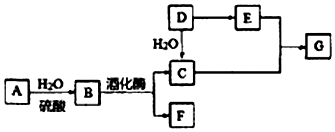
(1)D中官能团的名称:碳碳双键.
(2)C和E反应的化学方程式:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是新制氢氧化铜(或银氨溶液).
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5:1.
下列说法正确的是A.
A.X 不溶于水,与甲烷互为同系物 B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体 D.X可能和溴水发生加成反应.
分析 A是天然有机高分子化合物,在酸性条件下水解得B,B在酒化酶的作用下生成C和F,所以A为(C6H10O5)n,B为C6H12O6,G蒸气密度是氢气的44 倍,即G的相对分子质量为88,D是一种重要的化工原料,D与水加成得C,所以C为CH3CH2OH,F为CO2,则D为CH2=CH2,D氧化得E为CH3COOH,C和E发生酯化反应生成G为CH3COOCH2CH3,烃X的相对分子质量是D、F之和,即为72,分子中碳与氢的质量之比是5:1,则X为C5H12,据此答题.
解答 解:A是天然有机高分子化合物,在酸性条件下水解得B,B在酒化酶的作用下生成C和F,所以A为(C6H10O5)n,B为C6H12O6,G蒸气密度是氢气的44 倍,即G的相对分子质量为88,D是一种重要的化工原料,D与水加成得C,所以C为CH3CH2OH,F为CO2,则D为CH2=CH2,D氧化得E为CH3COOH,C和E发生酯化反应生成G为CH3COOCH2CH3,烃X的相对分子质量是D、F之和,即为72,分子中碳与氢的质量之比是5:1,则X为C5H12,
(1)根据上面的分析可知,D为CH2=CH2,D中官能团的名称为碳碳双键,
故答案为:碳碳双键;
(2)C和E发生酯化反应生成CH3COOCH2CH3,反应的化学方程式CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(3)检验A转化过程中有B生成,即检验葡萄糖的存在,先中和水解液,再需要加入的试剂是新制氢氧化铜(或银氨溶液),
故答案为:新制氢氧化铜(或银氨溶液);
(4)X为C5H12,是饱和烷烃,
A.C5H12 不溶于水,与甲烷互为同系物,故A正确;
B.C5H12在高温下会分解,故B错误;
C.C5H12的一种同分异构体为2-甲基丁烷,有三个甲基,故C错误;
D.烷烃和溴水不发生加成反应,故D错误;
故选A.
点评 本题考查有机物的推断,题目难度中等,确定G的组成是解题的关键,结合反应特点利用顺推法、逆推法相结合进行推断,注意掌握常见官能团的性质.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案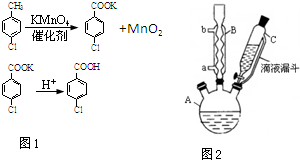 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应(图1)、装置图如图2:常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是球形冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
| A. | 增加药品 | B. | 减少药品 | C. | 增加砝码 | D. | 减少砝码 |
| A. | Ba2+、NO3-、NH4+、Cl- | B. | K+、Ba2+、Cl-、SO42- | ||
| C. | Al3+、CO32-、NH4+、AlO2- | D. | Cu2+、NH4+、SO42-、K+ |
| A. | 目前,工业上冶炼铝通常采用的方法是铝热反应法 | |
| B. | 铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 | |
| C. | 由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 | |
| D. | 在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得 |
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=1的溶液:K+、Na+、F-、Br- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式.
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为2.5mol/L.
(4)依据表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式.
 一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
一种“合成氨”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2.该反应过程与能量关系可用如图表示,完成反应的热化学方程式:N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.