题目内容
1.用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x>a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x>b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑;.
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)II中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x>c | 无明显变化 | 有Cl2 |
| Ⅴ | c<x<b | 无明显变化 | 无Cl2 |
②与II对比,得出的结论(写出两点):加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
分析 (1)Fe3+离子能与KSCN反应生成血红色络合物而使液体呈血红色;
(2)阳极上氯离子失电子生成氯气,氯气有强氧化性,能氧化亚铁离子生成铁离子,自身被还原生成氯离子;
(3)亚铁离子具有还原性,能失电子生成铁离子;
(4)①氯气具有强氧化性,能氧化碘离子生成碘,碘遇湿润的淀粉碘化钾试纸变蓝色;
②与II对比可知,IV中电解NaCl溶液,加大电压至cV以上时Cl-离子放电产生Cl2;电压减小至c>x≥b时,Cl-离子不放电,即Fe2+离子放电时的电压较低.
解答 解:(1)Fe3+离子能与KSCN反应生成血红色络合物而导致液体呈血红色,所以看到的现象为溶液变红,
故答案为:溶液变红;
(2)阳极上氯离子失电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;
氯气有强氧化性,能氧化亚铁离子生成铁离子,自身被还原生成氯离子,离子反应方程式为 Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:2Cl--2e-=Cl2↑;Cl2+2Fe2+=2Fe3++2Cl-;
(3)由Ⅱ可知,阳极产物无Cl2,而Fe2+离子具有还原性,则Fe2+可能在阳极放电,被氧化为Fe3+,
故答案为:还原;
(4)①检测氯气可以用湿润的淀粉碘化钾试纸,取少量阳极附近的溶液,滴在淀粉KI试纸上,若试纸变蓝,说明有Cl2存在;
②与II对比可知,IV中电解NaCl溶液,加大电压至cV以上时Cl-离子放电产生Cl2;电压减小至c>x≥b时,Cl-离子不放电,即Fe2+离子放电时的电压较低,则阳极放电顺序Fe2+>Cl-,
故答案为:加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
点评 本题考查电解原理、离子的检验、氧化还原反应等知识点,为高频考点,明确化学反应原理、离子性质等知识点是解本题关键,侧重考查学生实验分析判断及综合知识运用能力,题目难度中等.

| A. | 可以利用该反应检验Mn2+ | |
| B. | 配平后的系数为2、5、8、2、10、16 | |
| C. | 该反应中酸性介质不能为盐酸 | |
| D. | 若有0.1mol还原产物生成,则转移电子0.5mol |
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素肯定是金属元素 |
| A. | ②⑤ | B. | ②③④⑤ | C. | ③⑤ |
| A. | FeCl2 | B. | NaCl | C. | FeCl3 | D. | CuCl2 |
 .
.
 有机物X的键线式为:
有机物X的键线式为: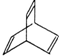
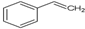
 .
.