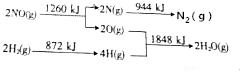
题目内容
6.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法不正确的是( )| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素肯定是金属元素 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,这四种元素的原子最外层电子数之和为22,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,然后结合元素周期律及元素化合物知识来解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,这四种元素的原子最外层电子数之和为22,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,
A.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故A错误;
B.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,硝酸中只含共价键,故B正确;
C.物质SiO2、Si3N4均为原子晶体,均有熔点高、硬度大的特性,故C正确;
D.Ge元素位于Si的下方,为金属元素,故D正确,
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的推断及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学键及晶体类型,题目难度不大.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
16.强酸和强碱的稀溶液反应的中和热可以表示为:H+(aq)+OH-(aq)=H2O ( l )△H=-57.3kJ•mol-1,
已知:CH3COOH (aq)+NaOH (aq)=CH3COONa (aq)+H2O ( l )△H=-Q1 kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH (aq)=$\frac{1}{2}$Na2SO4 (aq)+H2O ( l )△H=-Q2 kJ•mol-1,
上述反应均在溶液中进行,则下列关系正确的是( )
已知:CH3COOH (aq)+NaOH (aq)=CH3COONa (aq)+H2O ( l )△H=-Q1 kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH (aq)=$\frac{1}{2}$Na2SO4 (aq)+H2O ( l )△H=-Q2 kJ•mol-1,
上述反应均在溶液中进行,则下列关系正确的是( )
| A. | Q2>Q1>57.3 | B. | Q1=57.3<Q2 | C. | Q2>57.3>Q1 | D. | Q2=57.3>Q1 |
17.下列说法正确的是( )
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 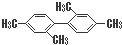 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 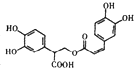 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
1.用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
(1)用KSCN检验出Fe3+的现象是溶液变红.
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑;.
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)II中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
①IV中检测Cl2的实验方法湿润的淀粉碘化钾试纸变蓝.
②与II对比,得出的结论(写出两点):加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x>a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x>b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑;.
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)II中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x>c | 无明显变化 | 有Cl2 |
| Ⅴ | c<x<b | 无明显变化 | 无Cl2 |
②与II对比,得出的结论(写出两点):加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
11. 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素能发生取代反应 | |
| C. | 青蒿素属于芳香族化合物 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取的原理 |
18.下列说法中正确的是( )
| A. | 红热的铁丝在氯气中燃烧产生棕色的雾 | |
| B. | 含有氯元素的物质都呈黄绿色,均有毒 | |
| C. | 氢气在氯气中燃烧时,火焰显淡蓝色 | |
| D. | 氯水中滴入硝酸银溶液和稀硝酸后,产生白色沉淀 |
15.某无色透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
| A. | H+、Cu2+、Cl-、SO42- | B. | HCO3-、NO3-、SO42-、Na+ | ||
| C. | Cl-、SO42-、K+、Na+ | D. | Fe3+、SO42-、Cl-、Al[(OH)4]- |
16.下列表格中各项分类都正确的一组是( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 冰水混合物 | CuSO4•5H2O | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 酒精 |
| C | 液氯 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |