题目内容
12.分析下表中各项的排布规律,按此规律排布第16项应为( )| 1 | 2 | 3 | 4 | 5 | 6 | … |
| C2H4 | C2H6 | C2H6O | C3H6 | C3H8 | C3H8O | … |
| A. | C6H14 | B. | C7H14 | C. | C7H16 | D. | C7H16O |
分析 由表格中的规律可知,每3个为一组,组内分别为烯烃、烷烃、饱和一元醇,$\frac{16}{3}$=5…1,以此来解答.
解答 解:由表格中的规律可知,每3个为一组,组内分别为烯烃、烷烃、饱和一元醇,$\frac{16}{3}$=5…1,可知第16项应为第5组的第1个,含C原子为2+5=7的烷烃为C7H14,
故选B.
点评 本题考查有机物分子式计算的确定,为高频考点,把握表格中的排布规律为解答的关键,侧重分析与计算能力的考查,注意数学归纳法的应用,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)=6.2×10-10mol/L、Ka(CH3COOH)=1.8×10-5mol/L、Ka(HNO2)=6.4×10-6mol/L、Ka(HF)=6.8×10-4mol/L.物质的量浓度都为0.1mol/L的下列溶液中,pH最小的是( )
| A. | HCN | B. | CH3COOH | C. | HNO2 | D. | HF |
3.判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
| A. | 浓盐酸 | B. | 硝酸 | C. | 王水 | D. | 稀硫酸 |
20.铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下:
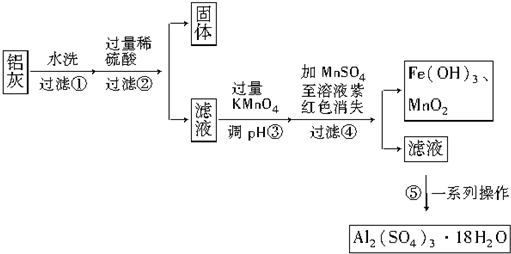
请回答下列问题:
(1)加入过量稀硫酸溶解Al2O3的离子方程式是6H++Al2O3═2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol•L-1的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是将Fe2+氧化为Fe3+,并使Fe3+转化为Fe(OH)3沉淀而除去;
若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤pH<3.4.
(4)操作④发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸和双氧水.
(5)操作⑤“一系列操作”,下列仪器中不需用的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀硫酸溶解Al2O3的离子方程式是6H++Al2O3═2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol•L-1的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤pH<3.4.
(4)操作④发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸和双氧水.
(5)操作⑤“一系列操作”,下列仪器中不需用的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
7.下列过程中,化学键未被破坏的是( )
| A. | 干冰升华 | B. | H2和Cl2反应生成HCl | ||
| C. | CO2气体溶于水 | D. | NaCl固体溶于水 |
17.下列说法正确的是( )
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 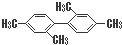 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 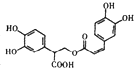 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
4.下列过程中,只破坏离子键的是( )
| A. | NO2被木炭吸附 | B. | NaHSO4加热至熔化 | ||
| C. | KHSO4晶体溶于水 | D. | Na2O2溶于水 |
1.用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压数值):
(1)用KSCN检验出Fe3+的现象是溶液变红.
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑;.
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)II中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
①IV中检测Cl2的实验方法湿润的淀粉碘化钾试纸变蓝.
②与II对比,得出的结论(写出两点):加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x>a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x>b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
(2)I中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出有关反应:2Cl--2e-=Cl2↑;.
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有还原性.
(4)II中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x>c | 无明显变化 | 有Cl2 |
| Ⅴ | c<x<b | 无明显变化 | 无Cl2 |
②与II对比,得出的结论(写出两点):加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl-.
2.下列关于碱金属的叙述叙述正确的是( )
| A. | 碱金属元素阳离子的氧化性随着原子序数的递增依次增强 | |
| B. | 碱金属的密度随着原子序数的递增逐渐减小 | |
| C. | 随着原子序数的递增,碱金属元素最高价氧化物的水化物的碱性依次减弱 | |
| D. | 钾与氧气或水反应比钠的反应剧烈,铷、铯发生类似的反应更剧烈 |