题目内容
8.常温常压下,2mol H2生成水蒸气放出484kJ热量.下列热化学方程式正确的是( )| A. | 2H2+O2═2H2O△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
分析 A、热化学方程式要标注状态;
B、根据氢气燃烧生成水蒸气的逆过程为吸热过程来分析;
C、根据反应放热时焓变符号为负来判断;
D、根据反应放热时焓变符号为负来判断.
解答 解:A、无状态,故A错误;
B、单位错误,应为kJ•mol-1,故B错误;
C、反应为放热反应,此时焓变符号为负,故C错误;
D、反应为放热反应,此时焓变符号为负,2mol H2生成水蒸气放出484kJ热量,2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1,故D正确.
故选D.
点评 本题主要考查学生热化学方程式的书写原则,该题型是现在高考的热点.

练习册系列答案
相关题目
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 室温下,21.0 g乙烯与丙烯的混合气体中含有的碳原子数为1.5 NA | |
| B. | 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA | |
| C. | 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA | |
| D. | 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA |
16.实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
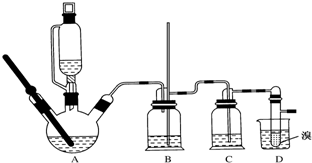
有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状 态 | 无 色 液 体 | 无 色 液 体 | 无 色 液 体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
3.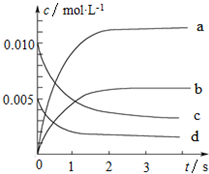 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
(1)从0~3s内,用NO表示的平均反应速率v(NO)=2.17×10-3mol•L-1•s-1.
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO浓度变化的曲线是c(填字母代号).
(3)达平衡时NO的转化率为65%.
(4)能说明该反应已达到平衡状态的是ACD(填序号).
A.混合气体的颜色保持不变
B.混合气体的密度保持不变
C.v逆 (NO2)=2v正 (O2)
D.混合气体的平均相对分子质量保持不变
(5)若升温到850℃,达平衡后n(NO)=n(NO2),则反应向逆反应方向(填“正反应方向”“逆反应方向”)移动.
(6)若在一定条件下0.2molNO气体与氧气反应,达平衡时测得放出的热量为akJ,此时NO转化率为80%,则2molNO气体完全反应放出的热量为12.5akJ.
13.下列说法中,不正确的是( )
| A. | 任何反应中的能量变化都表现为热量变化 | |
| B. | 任何化学反应都伴随着能量变化 | |
| C. | 反应物的总能量高于生成物的总能量,则反应释放能量 | |
| D. | 若化学键形成时释放的能量小于破坏旧化学键时所需要吸收的能量,则反应吸收能量 |
20.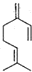 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
17.下列电子式中错误的是( )
| A. | Na+ | B. |  | C. |  | D. |  |
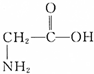 ) ④
) ④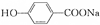 ⑤葡萄糖 ⑥乙酰水杨酸钠.
⑤葡萄糖 ⑥乙酰水杨酸钠.