题目内容
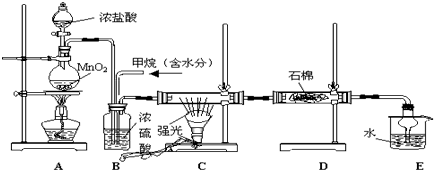
20. 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
分析 根据β-月桂烯含有三个双键,都能发生加成反应,且存在与1,3-丁二烯类似结构,则能发生1,4加成.
解答 解:因分子存在三种不同的碳碳双键,如图所示 ;1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,
;1分子物质与2分子Br2加成时,可以在①②的位置上发生加成,也可以在①③位置上发生加成或在②③位置上发生加成,
还可以1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成,故所得产物共有四种,
故选C.
点评 本题考查烯烃的加成反应,难度中等,明确加成的规律及利用结构与1,3-丁二烯类似来分析解答即可,难点是分析1分子Br2在①②发生1,4加成反应,另1分子Br2在③上加成.

练习册系列答案
相关题目
11.结构相似,在分子组成上相差一个或若干个“CH2”原子团的物质互称为同系物,则下列几组物质中一定为同系物的是( )
| A. | C3H6和C5H10 | B. | CH3CH(CH3)CH2CH3和CH3C(CH3)3 | ||
| C. | C2H6和C4H10 | D. | C2H4和CH2=CH-CH=CH2 |
8.常温常压下,2mol H2生成水蒸气放出484kJ热量.下列热化学方程式正确的是( )
| A. | 2H2+O2═2H2O△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
12.下列对各组物质性质的比较中,正确的是( )
| A. | 熔点:Li<Na<K | B. | 熔沸点:Al>Mg | C. | 密度:Na>Mg>Al | D. | 硬度:Mg<K |
9.甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品,下表列出了有关物质的部分物理性质,请回答:
)等产品,下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
实验室可用如图装置模拟制备苯甲醛,实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯挥发导致产率降低.三颈瓶中发生反应的化学方程式为 .此反应的原子利用率理论上可达66.25%.
.此反应的原子利用率理论上可达66.25%.
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲酸粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.下列情况会使测定结果偏低的是ad(填字母).
a.滴定时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品,下表列出了有关物质的部分物理性质,请回答:
)等产品,下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛,实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.

(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯挥发导致产率降低.三颈瓶中发生反应的化学方程式为
 .此反应的原子利用率理论上可达66.25%.
.此反应的原子利用率理论上可达66.25%.(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲酸粗产品.
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mo/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.下列情况会使测定结果偏低的是ad(填字母).
a.滴定时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配置KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液.
2.在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
(1)该实验的目的是探究该反应速率与亚硫酸钠溶液浓度、温度的关系,(2)表中V1=10mL.
2IO3-+5SO32-+2H+═I2+5SO42-+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
| 0.01mol•L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |

 .
.