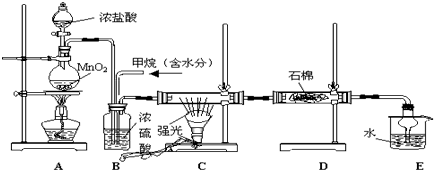
题目内容
16.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$\stackrel{H_{2}SO_{4}}{→}$CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸存在下在140℃脱水生成乙醚.
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
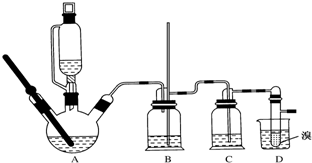
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状 态 | 无 色 液 体 | 无 色 液 体 | 无 色 液 体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
(2)在装置C中应加入d,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字);
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”“下”).
(5)若产物中有少量未反应的Br2,最好用c洗涤除去;(填正确选项前的字母)
a.水 b.碘化钠溶液 c.氢氧化钠溶液 d.乙醇.
分析 (1)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(2)浓硫酸具有强氧化性,可能氧化乙醇中的碳;
(3)乙烯和溴水发生了加成反应;
(4)根据1,2-二溴乙烷和水的密度相对大小解答;
(5)Br2可以和氢氧化钠发生氧化还原反应.
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,所以只要目的是减少副产物乙醚生成,
故答案为:减少副产物乙醚生成;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,所以装置C应该加入氢氧化钠溶液,
故答案为:d;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断该制备反应已经结束的最简单方法是:溴的颜色完全褪去,
故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案为:下;
(5)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,所以若产物中有少量未反应的Br2,最好用c氢氧化钠溶液洗涤除去,
故答案为:c.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
6.下列电子式书写正确的有( )
| A. | 氮分子  | B. | 过氧化氢  | C. | Na2O  | D. | 氯气  |
7.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同周期元素含氧酸的酸性随核电荷数的增加而增强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl?、S2?、K+、Ca2+半径逐渐减小 | |
| D. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 |
4.图是元素周期表的一部分,其中A、B、C为短周期主族元素,下列说法正确的是( )
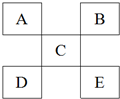

| A. | 如果D是金属元素,那么D元素的金属性比C强 | |
| B. | 元素C的最高价氧化物对应的水化物一定是强酸 | |
| C. | 元素B与氢形成的化合物中只能存在极性共价键 | |
| D. | 若E为非金属,则E的非金属性要强于B |
11.结构相似,在分子组成上相差一个或若干个“CH2”原子团的物质互称为同系物,则下列几组物质中一定为同系物的是( )
| A. | C3H6和C5H10 | B. | CH3CH(CH3)CH2CH3和CH3C(CH3)3 | ||
| C. | C2H6和C4H10 | D. | C2H4和CH2=CH-CH=CH2 |
1.某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L.向该混合液中加入1.92g铜粉,加热使反应发生完全.下列说法正确的是(忽略反应前后溶液体积变化)( )
| A. | 所得溶液中c(Cu2+)=0.225mol/L | |
| B. | 所得溶液中c(Cu2+)=0.03mol/L | |
| C. | 所得气体在标准状况下的体积为0.448L | |
| D. | 反应中转移0.06mol的电子 |
8.常温常压下,2mol H2生成水蒸气放出484kJ热量.下列热化学方程式正确的是( )
| A. | 2H2+O2═2H2O△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |