题目内容
5.现将2mol气体A与1mol气体B充入一个体积不变的容器内,发生反应:2A+B?C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )| A. | 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大 | |
| B. | 在上述平衡体系中再加入1molA和0.5molB,平衡正向移动,A的转化率增大 | |
| C. | 该反应的热化学方程式2A(g)+B(g)?C(g)+3D(l)+4E(g)△H=-QkJ/mol | |
| D. | 该反应在任何温度下都可自发进行 |
分析 恒温恒容条件下,反应前后气体总压强之比等于其物质的量之比,则反应后混合气体物质的量=$\frac{8.08×1{0}^{6}Pa}{6.06×1{0}^{6}Pa}$×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molD,
A.该反应中放出热量,则正反应是放热反应,反应前后气体压强增大,则反应前后气体物质的量之和增大;
B.在上述平衡体系中再加入1molA和0.5molB,相当于增大压强,平衡向气体体积减小的方向移动;
C.有1molA反应放出QkJ热量,则2molA完全反应放出2QkJ热量;
D.该反应的焓变小于0,熵变大于0.
解答 解:恒温恒容条件下,反应前后气体总压强之比等于其物质的量之比,则反应后混合气体物质的量=$\frac{8.08×1{0}^{6}Pa}{6.06×1{0}^{6}Pa}$×3mol=4mol,达到平衡时A的浓度减小一半,说明A的物质的量减小一半,即有1molA反应,则有0.5molB反应,生成0.5molC、1.5molD、2molD,
A.该反应中放出热量,则正反应是放热反应,反应前后气体压强增大,则反应前后气体物质的量之和增大,升高温度平衡逆向移动,气体的物质的量减小,则压强减小,故A错误;
B.在上述平衡体系中再加入1molA和0.5molB,相当于增大压强,平衡向气体体积减小的方向移动,即逆向移动,A的转化率减小,故B错误;
C.有1molA反应放出QkJ热量,则2molA完全反应放出2QkJ热量,且反应前后压强之比为3:4,气体的物质的量之比为3:4,E应该是液体,其热化学方程式为2A(g)+B(g)?C(g)+3D(g)+4E(l)△H=-2QkJ/mol,故C错误;
D.该反应的焓变小于0,熵变大于0,则△G=△H-T△S<0,该反应在任何温度下都可自发进行,故D正确;
故选D.
点评 本题考查化学平衡影响因素、化学平衡计算等知识点,侧重考查学生分析计算能力,明确道该反应中反应热、反应前后气体计量数之和变化是解本题关键,易错选项是C.

| A. | 用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果 | |
| B. | 淀粉、油脂、蛋白质都是天然高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 含硫化石燃料的大量燃烧是酸雨形成的主要原因之一 |
| A. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| B. | 含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Fe2+、Br- | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、AlO2-、CO32- |
| A. | NO2和N2O4浓度相等 | B. | NO2和N2O4分子数之比为2:1 | ||
| C. | 体系颜色不再发生变化 | D. | N2O4不再分解 |
| A. | NaOH | B. | Ba(OH)2 | C. | AgNO3 | D. | HCl |
| A. | 液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | SO2的水溶液能导电,所以SO2是电解质 | |
| C. | 蔗糖、酒精在水溶液里和熔融状态时均不导电,所以他们不是电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
 某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液由红色变为无色,半分钟不再变色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是DE(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
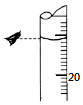
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为10.20 mL.若仰视,会使读数偏大(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710 mol•L-1.
| 滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | 1.34 | 19.39 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
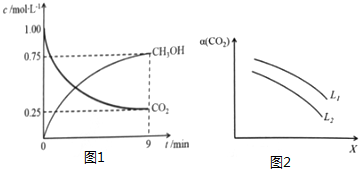 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如: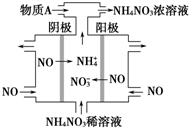 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: