题目内容
11gCO2的物质的量为 mol,在标准状况下的体积为 L;与 gSO3中所含的“O”原子数相当;如果将上述CO2通入200ml 2mol/L NaOH溶液中充分反应,所得溶液的主要成分为 (填化学式)其溶质的物质的量为 mol.
考点:物质的量的相关计算
专题:
分析:根据n=
计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳体积;根据含有氧原子数目相等计算gSO3的物质的量,再根据m=nM计算SO3的质量.可能发生反应:2NaOH+CO2═Na2CO3+H2O,NaOH+CO2=NaHCO3,NaOH物质的量为0.4mol,二氧化碳为0.25mol,n(NaOH):n(CO2)=1.6:1,介于1:1与2:1之间,故反应生成碳酸钠、碳酸氢钠,根据钠离子、碳元素守恒计算碳酸钠、碳酸氢钠的物质的量.
| V |
| Vm |
解答:
解:11g二氧化碳的物质的量为
=0.25mol,标况下二氧化碳体积为0.25mol×22.4L/mol=5.6L;与之含有氧原子数目相等gSO3的物质的量为
,SO3的质量
×80g/mol=
g;
可能发生反应:2NaOH+CO2═Na2CO3+H2O,NaOH+CO2=NaHCO3,NaOH物质的量为0.2L×2mol/L=0.4mol,二氧化碳为0.25mol,n(NaOH):n(CO2)=1.6:1,介于1:1与2:1之间,故反应生成碳酸钠、碳酸氢钠,设碳酸钠、碳酸氢钠的物质的量分别为xmol、ymol,根据钠离子、碳元素守恒,则:
,解得x=0.15,y=0.1,
故答案为:0.25;5.6;
g;Na2CO3、NaHCO3;n(Na2CO3)=0.15mol、n(NaHCO3)=0.1mol.
| 11g |
| 44g/mol |
| 0.25mol×2 |
| 3 |
| 0.25mol×2 |
| 3 |
| 40 |
| 3 |
可能发生反应:2NaOH+CO2═Na2CO3+H2O,NaOH+CO2=NaHCO3,NaOH物质的量为0.2L×2mol/L=0.4mol,二氧化碳为0.25mol,n(NaOH):n(CO2)=1.6:1,介于1:1与2:1之间,故反应生成碳酸钠、碳酸氢钠,设碳酸钠、碳酸氢钠的物质的量分别为xmol、ymol,根据钠离子、碳元素守恒,则:
|
故答案为:0.25;5.6;
| 40 |
| 3 |
点评:本题考查化学方程式计算、物质的量计算,难度中等,计算确定二氧化碳与氢氧化钠发生的反应是关键,注意对公式的理解掌握.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
已知某KOH样品中含水7.62%,含K2CO3 2.23%,含KOH 90%.现将1.00g 样品加入60.0mL 1.00mol/L的盐酸中,过量的酸用1.070mol/L KOH溶液中和.蒸发溶液,蒸发到无水时,可得的固体的质量为( )
| A、3.00g | B、3.43g |
| C、4.47g | D、无法计算 |
已知下列氧化剂均能氧化+4价的硫(元素),为了除去稀硫酸中的亚硫酸,宜选用的氧化剂是( )
| A、氯气 | B、双氧水 |
| C、过氧化钠 | D、高锰酸钾 |
下列说法正确的是( )
| A、固体NaCl不导电,所以NaCl是非电解质 |
| B、NH3、CO2的水溶液的导电,所以NH3、CO2是电解质 |
| C、铜、石墨均能导电,所以它们都是电解质 |
| D、蔗糖在水溶液中或熔融时均不导电,所以是非电解质 |
已知:①Cl2+KBr═2KCl+Br2;②KClO3+6HCl═3Cl2↑+KCl+3H2O;③2KBrO3+Cl2═Br2+2KClO3,下列说法正确的是( )
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、氧化性由强到弱的顺序是KBrO3>KClO3>Cl2>Br2 |
| C、反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D、反应③中1mol还原剂参加反应时氧化剂得到电子的物质的量为2 mol |
对于相同物质的量的SO2和SO3,下列说法中正确的是( )
| A、硫元素的质量比为 4:5 |
| B、分子数之比为3:4 |
| C、原子总数之比为3:4 |
| D、质量之比为1:1 |
“西北通道”是指从北大西洋、经加拿大北极群岛进入北冰洋、再进入太平洋的航道,是连接大西洋和太平洋的捷径.最新卫星测量结果显示,北极冰层融化加速,“西北通道”有望在2020年通航,要比专家预测提前30年.提前通航的主要原因是( )
| A、二氧化碳增多使太阳辐射到地球表面的能量增多 |
| B、二氧化碳等气体能释放能量,使大气层的温度升高 |
| C、氟氯烃等大量排放,破坏臭氧层引起的 |
| D、二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
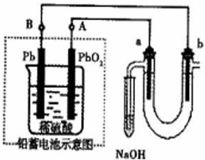 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)
用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)| A、铅蓄电池负极的反应式为:Pb-2e-=Pb2+ |
| B、铅蓄电池放电时,B极质量减轻,A极质量增加 |
| C、铅蓄电池充电时,A极应与外电源负极相连 |
| D、电解苦卤水时,a电极首先放电的是Br- |