题目内容
1.如图所示的装置能够组成原电池产生电流的是( )| A. |  Na2SO4溶液 | B. |  FeCl3溶液 | C. |  稀盐酸 | D. |  酒精 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A.两个电极材料相同,不能够组成原电池且产生电流,故A错误;
B.符合原电池的构成条件,Fe为负极,有电流产生,故B正确;
C.Zn与稀盐酸直接反应,没有形成闭合回路,不能形成原电池,故C错误;
D.酒精是非电解质,故D错误;
故选B.
点评 本题考查了原电池的构成条件,注意原电池的这几个条件必须同时具备,缺一不可,题目较简单.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
14.下列有机物的同分异构体数目最多的( )
| A. | C5H12 | B. | 甲苯的二氯代物 | C. | C6H14 | D. | C5H12O(醇类结构) |
9.下列叙述正确的是( )
| A. | 钢铁吸氧腐蚀过程中正极反应为2H++2e-═H2↑ | |
| B. | 惰性电极电解熔融NaCl时阴极、阳极产生气体体积比为1:1 | |
| C. | H2在反应Li2NH+H2═LiNH2+LiH中既是氧化剂又是还原剂 | |
| D. | 用铁做电极电解CuCl2溶液的离子方程式为Cu2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑ |
16.在含Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A. | NO3- | B. | Cl- | C. | CO32- | D. | SO32- |
11.80℃时,2L密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+53kJ•mol-1,获得如下数据:下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
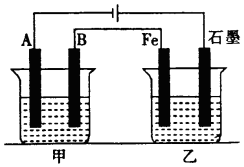 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: