题目内容
17.实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,相应的离子反应方程式为CO2+Ca2++2OH-═CaCO3↓+H2O;如果继续通入过量的CO2气体,则产生的实验现象是沉淀溶解,相应的离子反应方程式为CaCO3+CO2+H2O═Ca2++2HCO3-.分析 氢氧化钙与二氧化碳反应生成白色的碳酸钙沉淀Ca(OH)2+CO2═CaCO3↓+H2O,据此检验二氧化碳是否存在;若二氧化碳过量,生成的白色沉淀碳酸钙与二氧化碳反应生成可溶性的碳酸氢钙.
解答 解:实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,相应的离子反应方程式为:CO2+Ca2++2OH-═CaCO3+H2O;若继续通入过量的CO2气体,碳酸钙沉淀会与二氧化碳反应生成碳酸氢钙,沉淀被溶解,反应的离子方程式为:CaCO3+CO2+H2O═Ca2++2HCO3-,
故答案为:CO2+Ca2++2OH-═CaCO3↓+H2O,沉淀溶解;CaCO3+CO2+H2O═Ca2++2HCO3-.
点评 本题考查了离子方程式的书写,题目难度不大,明确离子方程式的书写方法以及反应原理是解答关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.当冰醋酸固体变成液体或气体时,一定发生变化的是( )
| A. | 分子内化学键 | B. | 共价键键能 | C. | 分子的构型 | D. | 分子间作用力 |
5.摩尔盐在工业上有重要的用途.已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成.步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液.
②取少量配制溶液,加入KSCN溶液,无明显现象.
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
④定量测定如下:
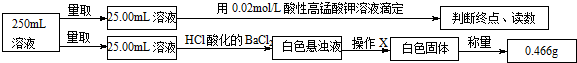
滴定实验结果记录如下:
完成下列填空:
(1)步骤①中需要的定量仪器为电子天平、250mL容量瓶.
(2)步骤②的目的是确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在.产生红褐色沉淀的离子方程式4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓.
(3)步骤④中操作X为过滤、洗涤、干燥或烘干(冷却)(按操作顺序填写).
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,不能(填“能”或“不能”),请说明理由碘单质与亚铁离子不反应.
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将偏小.(选填“偏大”、“偏小”或“不变”).
(6)通过上述实验测定结果,推断摩尔盐化学式为(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
①称取3.920g摩尔盐样品配制250mL溶液.
②取少量配制溶液,加入KSCN溶液,无明显现象.
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
④定量测定如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)步骤①中需要的定量仪器为电子天平、250mL容量瓶.
(2)步骤②的目的是确定红褐色沉淀中的铁元素在摩尔盐中是以亚铁离子形式存在.产生红褐色沉淀的离子方程式4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓.
(3)步骤④中操作X为过滤、洗涤、干燥或烘干(冷却)(按操作顺序填写).
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,不能(填“能”或“不能”),请说明理由碘单质与亚铁离子不反应.
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将偏小.(选填“偏大”、“偏小”或“不变”).
(6)通过上述实验测定结果,推断摩尔盐化学式为(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
12.现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素.下列说法不正确的是( )
| A. | 原子半径:Y<Q<W | |
| B. | ZX3可使紫色石蕊溶液变蓝 | |
| C. | X、Z、Q三种元素可组成离子化合物或共价化合物 | |
| D. | X2Q2、Y2X6两种分子中含有的电子数相同 |
2.下列物质中,即含有离子键,又含有共价键的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2O | D. | H2O2 |
9.短周期元素X、Y、Z、W、U原子序数依次增大.X与W位于同一主族,Y、Z形成的氧化物均是常见的耐火材料,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13.下列说法正确的是( )
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
 营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.
营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.