题目内容
6.已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H1=-25kJ/mol;②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H2=-47kJ/mol;
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H3=+19kJ/mol;
计算:FeO(s)+CO(g)=Fe(s)+CO2(g)反应的反应热△H=FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
分析 盖斯定律盖斯定律盖斯定律的含义是反应热是状态函数,与反应途径无关,根据目标方程式将已知的热化学方程式运用叠加的方法,得到目标方程式,反应热作相应的运算.
解答 解:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25KJ/mol
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47KJ/mol
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19KJ/mol
根据盖斯定律将方程式变形(3×①-②-2×③)÷6得:
Fe(s)+CO(g)═Fe(s)+CO2(g),
△H=(3×△H1-△H2-2×△H3)÷6=-11KJ/mol.
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11KJ/mol.
点评 本题考查利用盖斯定律求反应热,题目难度中等,易错点方程式混合运算、焓变运算时符合的改变和数值的运算.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 发酵粉就是NaHCO3,使用它可使生产的食品疏松可口 | |
| B. | 燃煤中添加适量的CaO,有利于降低酸雨形成的概率 | |
| C. | 放置较久的红薯比新挖出土的甜,可能与葡萄糖的水解有关 | |
| D. | 用液溴来吸收香蕉产生的乙烯,达到保鲜的目的 |
1.常温时,有4种由水电离出的c(H+)均为1×10-13mol/L的溶液:①HCl溶液;②CH3COOH溶液;③NaOH溶液;④氨水.有关上述溶液的比较中,正确的是( )
| A. | 向等体积的①、②溶液中分别加水稀释100倍后,溶液的pH:①<② | |
| B. | 将等体积的①、③溶液分别与足量铝粉反应,生成H2的物质的量相等 | |
| C. | ②、③溶液等体积混合后,溶液显碱性 | |
| D. | ①、④溶液混合若pH=7,则消耗溶液的体积:①>④ |
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,在浓硫酸的作用下乙醇和乙酸有一种能消耗完 |
18.下列有关氧元素及其化合物的表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: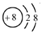 | |
| C. | 水分子的电子式: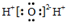 | |
| D. | 乙醛的结构简式:CH3COH |
16.关于有机物的下列说法不正确的是( )
| A. | 邻二甲苯、间二甲苯、对二甲苯沸点依次减小 | |
| B. | 蛋白质溶液加双缩脉试剂会显紫玫瑰色,与茚三酮溶液共热会显蓝紫色,与浓硝酸微热会产生黄色固体 | |
| C. | 在有机物 中至少有14个原子共平面 中至少有14个原子共平面 | |
| D. | 1.0mol 最多能与含3.0mol NaOH的水溶液完全反应 最多能与含3.0mol NaOH的水溶液完全反应 |
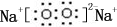 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022. ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.