题目内容
4.将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为( )| A. | 2.8 g | B. | 5.6 g | C. | 4.2 g | D. | 11.2 g |
分析 将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,依据反应定量关系计算.
解答 解:反应的离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,100mL 2mol/L的HNO3溶液中含有0.1L×2mol/L=0.2mol,
假设还原产物只有NO且HNO3完全反应,3Fe~8H+,
计算得到反应的铁物质的量=$\frac{0.2×3}{8}$mol=0.075mol,反应的铁的质量=0.075mol×56g/mol=4.2g,
故选C.
点评 本题考查了稀硝酸反应的离子方程式定量计算应用,主要是离子方程式的定量分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 乙酸 | C. | 乙醇 | D. | 甲烷 |
12.下列元素最高价氧化物的水化物溶于水一定是强碱溶液的是( )
| A. | 原子最外层只有1个电子的元素 | |
| B. | 原子次外层电子数是最外层电子数8倍的元素 | |
| C. | 原子次外层电子数是最外层电子数4倍的元素 | |
| D. | 原子的电子层数与最外层电子数相等的元素 |
9.下列反应中属于吸热反应的是( )
| A. | 铁跟盐酸反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 盐酸与氢氧化钠溶液反应 | |
| D. | 酒精燃烧 |
16.下列说法正确的是( )
| A. | 金属元素和非金属组成的化合物中的化学键一定是离子键 | |
| B. | HNO3和HCl都属于共价化合物 | |
| C. | 根据电离方程式HCl═H++Cl-,判断HCl分子里存在离子键 | |
| D. | 全部由非金属元素组成的化合物只能形成共价化合物 |
14.苹果iPad、iPhone正在中国热卖,但137名苹果公司驻中国供应工厂的员工,却因长期暴露在正己烷环境中,健康遭受不利影响.某同学欲按沸点高低将正己烷插入表中(已知表中5种物质已按沸点由低到高顺序排列),则正己烷最可能插入的位置是( )
| ① | ② | ③ | ④ | ⑤ |
| 甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 辛烷 |
| A. | ②③之间 | B. | ③④之间 | C. | ⑤之后 | D. | ④⑤之间 |

 ;X
;X .
. .
. 外的同分异构体结构体结构简式为
外的同分异构体结构体结构简式为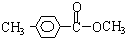 、
、 .
.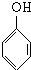 +nHCHO$\stackrel{一定条件}{→}$
+nHCHO$\stackrel{一定条件}{→}$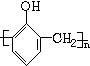 +nH2O.
+nH2O.