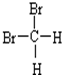
题目内容
12.下列元素最高价氧化物的水化物溶于水一定是强碱溶液的是( )| A. | 原子最外层只有1个电子的元素 | |
| B. | 原子次外层电子数是最外层电子数8倍的元素 | |
| C. | 原子次外层电子数是最外层电子数4倍的元素 | |
| D. | 原子的电子层数与最外层电子数相等的元素 |
分析 元素最高价氧化物的水化物溶于水一定是强碱溶液,则由原子结构判断为碱金属元素或某些碱土金属元素,以此来解答.
解答 解:A.原子最外层只有1个电子的元素,可能为H,故A不选;
B.原子次外层电子数是最外层电子数8倍的元素,可能为Na或K,元素最高价氧化物的水化物溶于水一定是强碱溶液,故B选;
C.原子次外层电子数是最外层电子数4倍的元素,为Mg元素或Ca元素,氢氧化镁为弱碱,故C不选;
D.原子的电子层数与最外层电子数相等的元素,可能为Be、Al,元素最高价氧化物的水化物溶于水不是强碱溶液,故D不选;
故选B.
点评 本题考查原子结构及元素的性质,为高频考点,把握电子层结构推断元素为解答的关键,侧重分析与应用能力的考查,注意金属与对应碱的碱性,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4.某有机物的结构简式为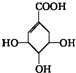 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )
 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机物能使溴的CCl4溶液褪色 | |
| B. | 该有机物在一定条件下可发生加聚反应,生成高分子化合物(C7H10O5)n | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 该有机物发生消去反应可得芳香烃 |
3.点燃某气体后,在火焰上方罩一个冷烧杯,内壁有水珠出现,罩一个沾有澄清石灰水的烧杯,石灰水变浑浊,则该气体不可能是( )
| A. | 天然气 | B. | 液化石油气 | C. | 水煤气 | D. | 氢气 |
7.区别浓H2SO4和稀H2SO4,既简单又可靠的方法是( )
| A. | 各取少许溶液分别放入铜片 | B. | 分别与石蕊试液作用 | ||
| C. | 用玻璃棒各蘸少许液涂在纸上 | D. | 观察溶液的颜色 |
4.将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为( )
| A. | 2.8 g | B. | 5.6 g | C. | 4.2 g | D. | 11.2 g |
1.国际无机化学命名委员会在1989年做出决定,建议把长式元素周期表原先的各族族号取消,由左至右改为18列.如碱金属元素为第1例,稀有气体元素为第18列.据此规定,下列说法错误的是( )
| A. | 第1列和第17列元素的单质熔沸点变化趋势相反 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第15列元素的最高价氧化物为R2O58 | |
| D. | 尚未发现的第113号元素在第七周期第13列 |
2.一定温度下,向某密闭容器中加入0.2mol CO和0.2mol H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),4min时反应达到平衡状态,测得n(CO):n(CO2)=3:2,下列说法正确的是( )
| A. | 缩小容器的体积,混合气体的密度不变 | |
| B. | v(CO)=v(CO2)时,表明反应达到平衡状态 | |
| C. | 平衡时CO和H2O的转化率相等 | |
| D. | 无法计算该条件下反应的化学平衡常数 |

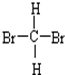 和
和