题目内容
14.苹果iPad、iPhone正在中国热卖,但137名苹果公司驻中国供应工厂的员工,却因长期暴露在正己烷环境中,健康遭受不利影响.某同学欲按沸点高低将正己烷插入表中(已知表中5种物质已按沸点由低到高顺序排列),则正己烷最可能插入的位置是( )| ① | ② | ③ | ④ | ⑤ |
| 甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 辛烷 |
| A. | ②③之间 | B. | ③④之间 | C. | ⑤之后 | D. | ④⑤之间 |
分析 对于烃,一般来说其相对分子质量越大,分子间作用力也越大,其沸点越大;对于相对分子质量相同的烷烃,支链越多,沸点越低.
解答 解:对于烃,一般来说其相对分子质量越大,分子间作用力也越大,其沸点越大,所以正己烷的沸点大于①②③,但比⑤低;对于相对分子质量相同的烷烃,支链越多,沸点越低,所以④的沸点比正己烷的沸点低,故沸点由低到高的顺序为:①<②<③<④<正己烷<⑤,
故选D.
点评 本题主要考查了有机物熔沸点的变化规律,掌握规律是解题的关键,题目难度不大.

练习册系列答案
相关题目
4.将过量铁粉放入100mL 2mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为( )
| A. | 2.8 g | B. | 5.6 g | C. | 4.2 g | D. | 11.2 g |
5.已知aAn+与bBm-具有相同的电子层结构.以下关于A、B元素性质的说法中,一定正确的有①原子半径:A<B ②原子序数:a=b+m+n ③原子最外层电子数:B>A④离子半径:aAn+<bBm- ⑤原子的失电子能力:A>B( )
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
2.一定温度下,向某密闭容器中加入0.2mol CO和0.2mol H2O,发生反应CO(g)+H2O(g)?CO2(g)+H2(g),4min时反应达到平衡状态,测得n(CO):n(CO2)=3:2,下列说法正确的是( )
| A. | 缩小容器的体积,混合气体的密度不变 | |
| B. | v(CO)=v(CO2)时,表明反应达到平衡状态 | |
| C. | 平衡时CO和H2O的转化率相等 | |
| D. | 无法计算该条件下反应的化学平衡常数 |
9.列反应属于取代反应的是( )
| A. | 乙醇与浓硫酸共热制乙醚 | B. | 乙醇使酸性高锰酸钾褪色 | ||
| C. | 乙醇与氧气点燃生成水和二氧化碳 | D. | 乙醇与浓硫酸共热制乙烯 |
19.下列关于实验的说法正确的是( )
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| C. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其的反应速率 | |
| D. | 用洁净的玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 |
6.下列关于指定粒子构成的叙述中,不正确的是( )
| A. | 37Cl与39K具有相同的中子数 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 | |
| C. | H3O+与OH-具有相同的质子数和电子数 | |
| D. | O22-与S2-具有相同的质子数和电子数 |
3.溴化碘(IBr)的化学性质与氯气相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等.其与水反应的方程式为:IBr+H2O=HBr+HIO下列关于IBr的叙述中不正确的是( )
| A. | IBr可能是一种有色物质 | |
| B. | 在许多反应中IBr是强氧化剂 | |
| C. | 在IBr与水的反应中,IBr既是氧化剂又是还原剂 | |
| D. | 与NaOH溶液反应有NaIO生成 |
4.下列有关化学用语使用不正确的是( )
| A. | 硫离子的结构示意图: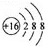 | |
| B. | 原子核内有10个中子的氧离子:${\;}_{8}^{18}$O2- | |
| C. | NH4Cl的电子式: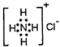 | |
| D. | 碘的外围电子排布:4s24p5 |