题目内容
7.将2.3g钠投放到97.8g水中,求所得溶液中溶质的质量分数.分析 钠投入到水中,发生反应方程式为:2Na+2H2O=2NaOH+H2↑,根据反应的化学方程式计算生成NaOH的质量、氢气质量,溶液的质量=钠的质量+水的质量-氢气质量,进而计算溶质的质量分数.
解答 解:将4.6g钠投入到97.8g水中,则:
2Na+2H2O=2NaOH+H2↑
46g 80g 2g
2.3g m(NaOH) m(H2)
m(NaOH)=$\frac{2.3g×80g}{46g}$=4.0g,
m(H2)=$\frac{2.3g×2g}{45g}$=0.1g,
则w(NaOH)=$\frac{4g}{2.3g+97.8g-0.1g}$×100%=4%,
答:所得溶液中溶质的质量分数为4%.
点评 本题考查化学方程式是计算、溶液质量分数的计算,题目难度不大,关键是计算溶液质量.

练习册系列答案
相关题目
17.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
18.短周期元素X,Y,Z,W在元素周期表中对应的相应位置如图所示.已知是Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>Y | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均可与Mg形成离子化合物 | D. | 氧化物对应水化物的酸性:W>Y |
15.下列有关Na2CO3 和NaHCO3的说法错误的是( )
| A. | 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少 | |
| B. | 将石灰水分别加入NaHCO3和Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下Na2CO3 比NaHCO3更易溶于水 | |
| D. | Na2CO3 固体中含少量NaHCO3,可用加热法除去 |
2.在标准状况下,与12g H2的体积相等的N2( )
| A. | 质量为12g | B. | 物质的量为6mol | ||
| C. | 体积约为22.4L | D. | 分子数约为6.02×1023 |
12.分别用10mL1mol/LAgNO3溶液与相同体积的下述溶液恰好完全反应则下述溶液中物质的量最大的是( )
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
19.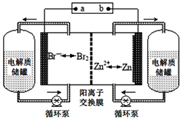 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
16.下列有关叙述正确的是( )
| A. | 合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol | |
| C. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)能自发进行,则该反应的△H>0 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g);△H1,2C(s)+O2(g)═2CO(g);△H2.则△H1<△H2 |
17.在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |