题目内容
5.科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如图1).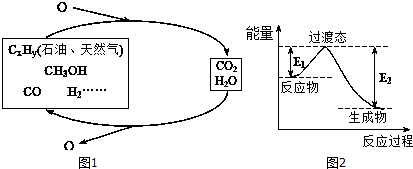
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.已知破坏1mol不同共价键的能量(kJ)分别是:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
②实验2条件下的平衡常数K=1.
③实验3中,若平衡时H2O的转化率为$\frac{1}{3}$,则$\frac{a}{b}$=0.5,c=$\frac{b}{3}$.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正=V逆(填“<”,“>”,“=”).
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理如果向反应后的溶液中加入少量的酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的PH变化不大,如果加入少量的碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的PH变化也不大,因此反应后溶液可以作缓冲液.
分析 (1)反应热等于反应物总键能减去生成物的总键能,而二氧化碳与氢气反应生成甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ•mol-1=-181.6kJ•mol-1,由图可知:△H=E1-E2,由此分析解答;
(2)①650℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 4 2 0 0
转化量(mol)1.6 1.6 1.6 1.6
平衡量(mol)2.4 0.4 1.6 1.6
因为两的计量数相等,所以反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=$\frac{1.6×1.6}{2.4×0.4}$=$\frac{8}{3}$;
900℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)2 1 0 0
转化量(mol)$\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
平衡量(mol)$\frac{4}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
此时平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{4}{3}×\frac{1}{3}}$=1,而$\frac{8}{3}$>1,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,由此分析解答;
②根据以上分析可知实验2条件下的平衡常数K=1;
③实验3中,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)a b 0 0
转化量(mol)c c c c
平衡量(mol)a-c b-c c c
若平衡时H2O的转化率为$\frac{1}{3}$,则b=3c,
又因为$\frac{c×c}{(a-c)(b-c)}=1$,
解得b=2a,由此分析解答;
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,所以Qc=1=K;
(3)①将100mL0.1mol/LNa2CO3的溶液溶质的物质的量为:0.1L×0.1mol/L=0.01mol,112mLCO2的物质的量为:0.005mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,二者反应碳酸钠过量为0.005mol,同时生成0.01mol的NaHCO3,碳酸根离子的水解程度大于碳酸氢根离子,由此分析各离子的浓度;
②当往溶液中加入一定量的酸时碳酸钠结合氢离子而加碱时碳酸氢根离子与氢氧根离子反应,所以溶液的酸碱性基本不变.
解答 解:(1)反应热等于反应物总键能减去生成物的总键能,而二氧化碳与氢气反应生成甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知该反应的反应热△H=(2×745+3×436-2×462.8-3×413.4-351-462.8)kJ•mol-1=-181.6kJ•mol-1,由图可知:△H=E1-E2,所以E2=E1-△H=8.2kJ•mol-1+181.6kJ•mol-1=189.8kJ•mol-1,故答案为:198.8;(2)①<;②1;③0.5,c=b/3;④=
(3)①c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);②向反应后的溶液中加入少量酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的pH变化不大;加入少量碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的pH变化也不大
(2)①650℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)4 2 0 0
转化量(mol)1.6 1.6 1.6 1.6
平衡量(mol)2.4 0.4 1.6 1.6
因为两的计量数相等,所以反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则该反应的平衡常数为K=$\frac{1.6×1.6}{2.4×0.4}$=$\frac{8}{3}$;
900℃根据方程式可知
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)2 1 0 0
转化量(mol)$\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
平衡量(mol)$\frac{4}{3}$ $\frac{1}{3}$ $\frac{2}{3}$ $\frac{2}{3}$
此时平衡常数K=$\frac{\frac{2}{3}×\frac{2}{3}}{\frac{4}{3}×\frac{1}{3}}$=1,而$\frac{8}{3}$>1,这说明升高温度平衡常数减小,因此升高温度平衡向逆反应方向进行,即正反应是放热反应,则该反应的△H<0,故答案为:<;
②根据以上分析可知实验2条件下的平衡常数K=1,故答案为:1;
③实验3中,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol)a b 0 0
转化量(mol)c c c c
平衡量(mol)a-c b-c c c
若平衡时H2O的转化率为$\frac{1}{3}$,则b=3c,
又因为$\frac{c×c}{(a-c)(b-c)}=1$,
解得b=2a,即$\frac{a}{b}$=0.5,c=$\frac{b}{3}$,故答案为:0.5;$\frac{b}{3}$;
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时浓度熵Qc=1=K,因此反应恰好是平衡状态,则V正=V逆,故答案为:=;
(3)①将100mL0.1mol/LNa2CO3的溶液溶质的物质的量为:0.1L×0.1mol/L=0.01mol,112mLCO2的物质的量为:0.005mol,发生反应Na2CO3+CO2+H2O=2NaHCO3,二者反应碳酸钠过量为0.005mol,同时生成0.01mol的NaHCO3,碳酸根离子的水解程度大于碳酸氢根离子,所以离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②当往溶液中加入一定量的酸时碳酸钠结合氢离子而加碱时碳酸氢根离子与氢氧根离子反应,所以溶液的酸碱性基本不变,故答案为:如果向反应后的溶液中加入少量的酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的PH变化不大,如果加入少量的碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的PH变化也不大,因此反应后溶液可以作缓冲液.
点评 考查反应热、平衡常数计算、外界条件对平衡状态的影响以及溶液中离子浓度大小比较等.

 阅读快车系列答案
阅读快车系列答案| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL 0.1mol/L MgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀.
(1)分别向两支试管中加入不同试剂,记录实验现象如表:
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动.
猜想2:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动.
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解.
①实验证明猜想正确的是1(填“1”或“2”).
②验证猜想时,设计实验向氢氧化镁沉淀中加NH4Cl和氨水混合液的理由是做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
| A. | MgCO3与盐酸反应:CO32-+2H+=CO2↑+2H2O | |
| B. | FeBr2与少量的Cl2反应:Fe2++Cl2=Fe3++2Cl- | |
| C. | 镁与醋酸反应 Mg+2H+=Mg2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
| A. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| B. | 1L1 mol.L-1CuCl2溶液含有2nA个Cl- | |
| C. | 1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2nA个电子 | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1nA |
 .
.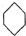 (g)?3H2(g)+
(g)?3H2(g)+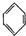 (g)△H1
(g)△H1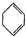 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol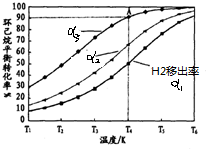
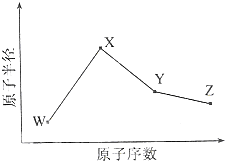 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.