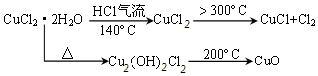题目内容
5.金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系,不全部是通过一步反应完成的是( )| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Cu→CuCl2→Cu(OH)2→CuSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
分析 Na、Al、Cu、Fe能和酸反应生成盐,能被氧化性强的单质氧气氧化生成氧化物,再结合复分解反应条件来分析解答,注意氧化物和碱之间的转化,以此解答该题.
解答 解:A.Na→NaOH→Na2CO3→NaCl中反应方程式分别为:2Na+2H2O=2NaOH+H2↑、2NaOH+CO2=Na2CO3 +H2O、Na2CO3+CaCl2=CaCO3↓+2NaCl,所以能一步实现,故A不选;
B.氧化铝和水不反应,所以不能一步生成氢氧化铝,故B选;
C.铜和氯气反应生成氯化铜、氯化铜与氢氧化钠反应生成氢氧化铜,然后和硫酸反应生成硫酸铜,可一步转化,故C不选;
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3 中反应方程式分别是Fe+2HCl=FeCl2+H2↑、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以能一步实现,故D不选.
故选B.
点评 本题考查了物质间的转化,明确物质的性质是解本题关键,根据物质的性质来分析解答,以Na、Al、Cu、Fe为知识点构建知识网络,元素化合物知识常常在工艺流程中出现,还常常与基本实验操作、物质的分离与提纯、离子的检验等知识点联合考查,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
16.某金属分别与足量的硫和氯气化合时,1mol金属推动的电子分别为6.02×1023和1.204×1024,该金属是( )
| A. | Na | B. | Ca | C. | Fe | D. | Cu |
13.FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A. | 溶液中一定不含Fe3+ | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定不含Cu2+ | D. | 剩余固体中一定含Cu |
20.化学在生活中有着广泛的应用,下列说法错误的是( )
| A. | 工业上用生石灰做脱硫剂 | B. | 氯化铁腐蚀铜刻制印刷电路板 | ||
| C. | 明矾可用做净水剂 | D. | 氢氟酸可用玻璃器皿存放 |
10.根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K11=4.3×10-7 |
| K12=5.6×10-11 |
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(ClO-)+c(OH-)+c(HCO3-) |
14.工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是 ( )
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |