题目内容
10.根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K11=4.3×10-7 |
| K12=5.6×10-11 |
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(ClO-)+c(OH-)+c(HCO3-) |
分析 依据表提供的弱电解质电离常数数据可知,酸性:H2CO3>HClO>HCO3-;酸性越强,对应盐的水解程度越小,则等浓度的NaClO、NaHCO3混合溶液中碳酸氢根离子的水解程度小于次氯酸根离子的水解程度,再依据溶液中电荷守恒,离子浓度大小比较依据,物料守恒等分析判断.
解答 解:A.等浓度的NaClO、NaHCO3混合溶液中,HCO3-的水解程度小于ClO-的水解程度,则溶液中离子浓度大小为:c(HCO3-)>c(ClO-)>c(OH-),故A正确;
B.等浓度的NaClO、NaHCO3混合溶液中,HCO3-的水解程度小于ClO-的水解程度,则c(HCO3-)>c(ClO-),正确的离子浓度大小为:c(ClO-)>c(HCO3-)>c(H+),故B错误;
C.根据混合液中的物料守恒可得:c(HClO)+c(ClO-)=c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故C错误;
D.根据溶液中的电荷守恒可知:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D错误;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生分析能力及灵活应用能力.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
18.下列关于物质分类的说法正确的是( )
| A. | 金属氧化物都是碱性氧化物 | |
| B. | 氨水和液氯都是纯净物 | |
| C. | CuSO4溶液和Al(OH)3胶体都能产生丁达尔效应 | |
| D. | 碳酸氢钠属于盐类 |
5.金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系,不全部是通过一步反应完成的是( )
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Cu→CuCl2→Cu(OH)2→CuSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
15.用固体样品配制一定物质的量浓度的溶液,下列图示对应的有关操作规范的是( )
| A. |  称量 称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
2.下列与有机物的结构、性质的有关叙述中正确的是( )
| A. | 天然油脂的主要成分是高级脂肪酸 | |
| B. | 分馏、干馏都是物理变化,裂化、裂解都是化学变化 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| D. | 乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应 |
19.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA | |
| B. | 常温常压下,16gCH4所含中子数目为8NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
20.物质的量浓度均为1mol/L的下列电解质溶液各取10mL混合后,pH小于7的是( )
| A. | Ba(OH)2、NaHSO4 | B. | Na2CO3、HNO3 | C. | NaHCO3、AlCl3 | D. | NaOH、CH3COOH |
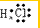 ;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是
;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是 .
. →
→ .
.