题目内容
16.某金属分别与足量的硫和氯气化合时,1mol金属推动的电子分别为6.02×1023和1.204×1024,该金属是( )| A. | Na | B. | Ca | C. | Fe | D. | Cu |
分析 根据金属分别与足量的硫和氯气化合时,1mol金属失去的电子分别为6.02×1023即1mol和1.204×1024即2mol,说明该金属与足量的硫化合时生成+1价的硫化物,和氯气化合时生成+2价的氯化物,据此分析.
解答 解:该金属分别与足量的硫和氯气化合时,1mol金属失去的电子分别为6.02×1023即1mol和1.204×1024即2mol,说明该金属与足量的硫化合时生成+1价的硫化物,和氯气化合时生成+2价的氯化物,
A、Na只有+1价,故A错误;
B、Ca只有+2价,故B错误;
C、Fe与S化合生成+2价的FeS,与氯气生成+3价的FeCl3,故C错误;
D、Cu与S化合生成+1价的Cu2S,与氯气生成+2价的CuCl2,故D正确;
故选:D.
点评 本题主要考查了元素化合物的性质,难度不大,注意变价金属的反应产物的判断.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
6.五种短周期元素的某些性质如表所示.下列说法正确的是( )
| 元素代号 | X | Y | Z | W | Q |
| 原子半径(nm) | 0.073 | 0.077 | 0.099 | 0.102 | 0.118 |
| 主要化合价 | -2 | +4、-4 | -1 | +6、-2 | +3 |
| A. | 单质沸点:W>Q>Z | |
| B. | W与Q形成的常见化合物可以稳定存在于水溶液中 | |
| C. | Z的含氧酸的酸性大于W的含氧酸的酸性 | |
| D. | X、Y、W三种元素两两之间均能以共价键形成AB2型的化合物 |
7.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 2.24LH2O含有的分子数等于0.1NA | |
| B. | 1.12LO2和1.12LN2所含原子数一定相等 | |
| C. | 分子数为NA的CO气体质量为28克 | |
| D. | 500mL2mol/L的氯化钙溶液中Cl数目为NA |
8.下列关于合金的叙述正确的是( )
| A. | 大多数合金的熔点比它的各成分金属的高 | |
| B. | 生铁和钢都是铁的合金,生铁的含碳量低于钢 | |
| C. | 日常生活中使用更多的是纯金属而不是合金 | |
| D. | 青铜是我国使用最早的合金 |
5.金属及其化合物转化关系是化学学习的重要内容之一.下列各组物质的转化关系,不全部是通过一步反应完成的是( )
| A. | Na→NaOH→Na2CO3→NaCl | B. | Al→Al2O3→Al(OH)3→AlCl3 | ||
| C. | Cu→CuCl2→Cu(OH)2→CuSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
 、
、 、
、 .
.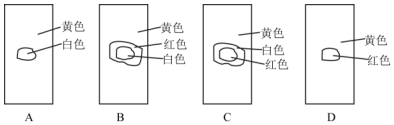

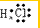 ;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是
;由两种元素组成的共价化合物的水溶液显碱性,这种化合物的结构式是 .
. →
→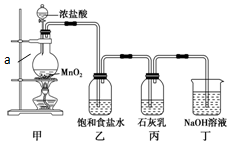 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.