题目内容
14.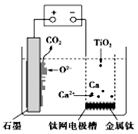 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金金属钛.下列说法中错误的是( )
| A. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| B. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| C. | 若用铅蓄电池作供电电源,“一”接线柱应连接Pb电极 | |
| D. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子 |
分析 根据图知,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2$\frac{\underline{\;一定条件\;}}{.}$Ti+2CaO,“+”接线柱应连接原电池正极,“-”接线柱应连接原电池负极,据此分析解答.
解答 解:A.阳极上电极反应式为C+2O2--4e-═CO2↑,故A正确;
B.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变,故B正确;
C.“-”表示原电池负极,所以“-”接线柱应连接原电池负极,即Pb极,故C正确;
D.由TiO2制得1mol金属Ti,Ti元素化合价由+4价降低到0价,则理论上外电路转移4mol电子,故D错误.
故选D.
点评 本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该类题目的关键.本题难度中等,是中档题.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
4.(NH4) 2SO4在一定条件下发生如下反应:4(NH4) 2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应.下列说法正确的是( )
| A. | 生成的沉淀是BaSO4 | |
| B. | 生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1 | |
| C. | 生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为l:3 | |
| D. | 从溶液中逸出的气体只有N2,最后留下溶液中溶质是NH4C1 |
5.以下指定实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实 验 操 作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置 于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 将CO2通入Na2SiO3水溶液观察是否有沉淀产生 | 探究碳和硅两元素非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
9.下列说法不正确的是( )
①有化学键被破坏的变化就是化学变化
②用化学键的强弱可以判断氯化钠与溴化钠,氯化氢与溴化氢的熔沸点高低
③质子数相同的微粒不一定是同种元素
④如果ⅡA族某元素原子序数为x,则同周期ⅢA族的元素的原子序数为x+1
⑤如果三周期某元素原子序数为x,则同主族四周期的元素的原子序数为x+8
⑥ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物酸性越强.
①有化学键被破坏的变化就是化学变化
②用化学键的强弱可以判断氯化钠与溴化钠,氯化氢与溴化氢的熔沸点高低
③质子数相同的微粒不一定是同种元素
④如果ⅡA族某元素原子序数为x,则同周期ⅢA族的元素的原子序数为x+1
⑤如果三周期某元素原子序数为x,则同主族四周期的元素的原子序数为x+8
⑥ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物酸性越强.
| A. | ①②④⑤ | B. | ③⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
19.已知2SO2(g)+O2(g)?2SO3(g)为放热反应,对该反应的下列说法正确的是( )
| A. | 1mol O2的能量一定高于2mol SO2的能量 | |
| B. | 1mol SO2的能量一定高于1mol SO3的能量 | |
| C. | 因为该反应是放热反应,所以不必加热就可以发生 | |
| D. | 2mol SO3的能量一定低于2mol SO2和1mol O2的总能量 |
6.下列有关甲烷的说法正确的是( )
| A. | 易溶于水 | B. | 是天然气的主要成分 | ||
| C. | 点燃前不需要验纯 | D. | 与乙烷互为同分异构体 |
4.证明溴乙烷中溴元素的存在,下列操作步骤正确的是( )
①加入AgNO3溶液;②加入NaOH水溶液;③加热;④加入蒸馏水⑤加稀硝酸至酸性;⑥加入NaOH醇溶液.
①加入AgNO3溶液;②加入NaOH水溶液;③加热;④加入蒸馏水⑤加稀硝酸至酸性;⑥加入NaOH醇溶液.
| A. | ⑥③⑤① | B. | ①②③⑤ | C. | ④⑥③① | D. | ④③①⑤ |

 .
. .
. .
. .
.