题目内容
7.化学与科学、技术、社会、环境密切相关,下列有关说法中正确的有( )| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
分析 A.黑色金属材料通常包括铁、铬、锰以及它们的合金;
B.化学变化有新物质生成,物理变化没有新物质生成;
C.依据胶体分散质粒度介于1nm-100nm之间,结合胶体的性质解答;
D.Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都有新物质生成.
解答 解:A.黑色金属材料通常包括铁、铬、锰以及它们的合金,铜属于有色金属,故A错误;
B.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,是应为料酒中醇和食醋中乙酸发生了酯化反应,生成了有香味的乙酸乙酯,属于化学变化,故B错误;
C.胶体分散质粒度介于1nm-100nm之间,胶体具有丁达尔效应属于光的散射现象,而放映室射到银幕上的光柱的形成也属于光的散射现象,属于胶体的丁达尔效应,故C正确;
D.Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都有新物质生成,都是化学变化,故D错误;
故选:C.
点评 本题考查了化学变化、物理变化的判断,金属的分类,胶体的本质特征及性质,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
17.下列说法中,正确的是( )
| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
18.下列过程中,共价键被破坏的是( )
| A. | 木炭吸附溴蒸气 | B. | 干冰升华 | C. | 葡萄糖溶于水 | D. | 氯化氢溶于水 |
15.短周期元素V、X、Y、Z、W原子序数依次增大,其中,V为原子半径最小的原子,X与Y、Z与W的核外电子层数相同,最大层电子数依照Z,X,Y,W的顺序成公差为1的等差数列,元素X、W的原子序数之和是Y的3倍.以下说法中正确的是( )
| A. | 简单离子半径从小到大:V、Y、X、W、Z | |
| B. | X、Y、Z均只能与V形成共价化合物 | |
| C. | 气态氢化物稳定性:X<W,其中的原因是X-V键的键能小于W-V键 | |
| D. | Z与碳元素形成的一种常见化合物的分子式为ZC |
2.苯佐卡因(对氨基苯甲酸乙酯)为白色粉末,常用于创面、溃疡面及痔疮的镇痛.实验室制备苯佐卡因的反应、装置示意图和有关数据如下:
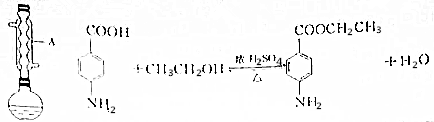
实验步骤:在圆底烧瓶中加入2~3片碎瓷片,0.00300mol对氨基苯甲酸、0.0150mol乙醇和数滴浓硫酸,振荡,然后将烧瓶在水浴上加热回流1h,冷却后,分批加入NaHCO3溶液直至无明显气泡产生,再加入少量NaHCO3溶液至pH≈8.将烧瓶中的液体倒入分液漏斗中,用乙醚分两次萃取,向分液所得的乙醚层中加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,最后蒸馏,蒸出乙醚,得苯佐卡因0.198g.
回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)碎瓷片的作用是防止暴沸.
(3)本实验中加入过量乙醇的目的是提高对氨基苯甲酸的利用率.
(4)加入NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(5)分液漏斗使用之前必须进行的操作是查漏;分液时,应先将下层液从分液漏斗下口放出,再将上层液从上口倒出.
(6)实验中加入少量无水硫酸镁的目的是吸收乙醚中的水.
(7)本实验中苯佐卡因的产率是40%(保留三位有效数字).
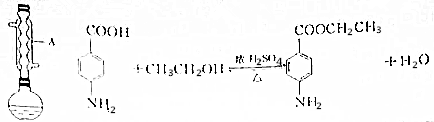
| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 340 | 微溶 |
| 苯佐卡因 | 165 | 1.039 | 90 | 172 | 难溶 |
| 乙醚 | 74 | 0.71 | -116.3 | 35 | 微溶 |
回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)碎瓷片的作用是防止暴沸.
(3)本实验中加入过量乙醇的目的是提高对氨基苯甲酸的利用率.
(4)加入NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(5)分液漏斗使用之前必须进行的操作是查漏;分液时,应先将下层液从分液漏斗下口放出,再将上层液从上口倒出.
(6)实验中加入少量无水硫酸镁的目的是吸收乙醚中的水.
(7)本实验中苯佐卡因的产率是40%(保留三位有效数字).
12.新版人民币的发行,引发了人们对有关人民币中化学知识的关注.下列表述不正确的是( )
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 用于人民币票面文字等处的油墨中所含有的氧化铁是一种磁性物质 | |
| C. | 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉 |
19.下列说法正确的是( )
| A. | 导电太阳能电池使用的高纯硅在工业生产过程中实现了零污染 | |
| B. | 生物质能来源于植物及其加工产品贮存的能量,姑动物粪便不属于生物质能 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 金刚石、C60、纳米碳管都是碳的同素异形体,都属于原子晶体,金刚石、石墨碳纳米管、C60均有很高的熔沸点. |
15.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合溶液实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
16.常温下,下列溶液的离子浓度关系式正确的是( )
| A. | 浓度相同的Na2CO3和NaHCO3混合溶液中,c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1mol/L①醋酸②氯化铵③硫酸溶液中,水电离产生的氢离子浓度大小顺序是②>①>③ | |
| C. | 0.1mol/L的NaHCO3溶液中 C(Na+)+c(H+)=c(OH-)+c(HCO3-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):③>②>① |