题目内容
用铝热法还原下列化合物,制得金属各1mol,需消耗铝最少的是( )
| A、MnO2 |
| B、WO3 |
| C、Fe3O4 |
| D、Cr2O3 |
考点:化学方程式的有关计算
专题:
分析:根据化合价的变化判断,化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少.
解答:
解:A.MnO2中Mn的化合价为+4,
B.WO3中W的化合价为+6,
C.Fe3O4中Fe的平均化合价为+
,
D.Cr2O3中Cr的化合价为+3,
Fe元素化合价变化最小,根据电子转移守恒,故生成1molFe时,转移电子最少,消耗Al最少,
故选C.
B.WO3中W的化合价为+6,
C.Fe3O4中Fe的平均化合价为+
| 8 |
| 3 |
D.Cr2O3中Cr的化合价为+3,
Fe元素化合价变化最小,根据电子转移守恒,故生成1molFe时,转移电子最少,消耗Al最少,
故选C.
点评:本题考查氧化还原反应的计算,注意从化合价变化的角度判断,题目难度不大.

练习册系列答案
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
相同物质的量浓度的NaCN和NaClO溶液相比,前者的pH较大,则下列有关同温、同体积和同浓度的HCN和HClO叙述中,正确的是( )
| A、酸性:HCN>HClO |
| B、浓度:c(CN-)<c(ClO-) |
| C、pH:HClO>HCN |
| D、与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
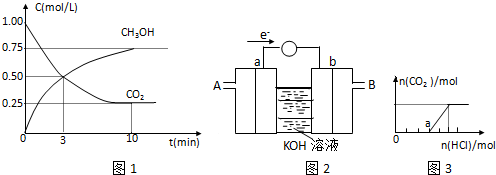
 甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.
甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题. 下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题: