题目内容
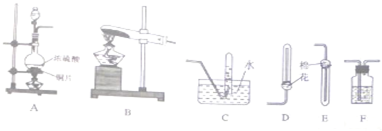
 下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:
下列是与硫元素相关的一系列实验:根据下图所示实验回答下列问题:(1)试管C口部的棉团上(碱过量)发生反应的离子方程式是
(2)反应一段时间后,停止反应,将B试管中的溶液加热,可以观察到
(3)试管C口部的棉团既可浸碱溶液,又可浸NaHCO3溶液,其作用是
(4)如将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)试管C口部的棉团浸有NaOH,可与二氧化硫反应防止污染空气;
(2)二氧化硫的漂白作用是形成不稳定的无色物质,加热恢复原来的颜色,二氧化硫与硫化氢发生氧化还原反应;
(3)从吸收二氧化硫,防止污染气体排放到大气中分析,结合NaHCO3溶液与二氧化硫的反应是利用亚硫酸酸性强于碳酸进行分析书写;
(4)二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸.
(2)二氧化硫的漂白作用是形成不稳定的无色物质,加热恢复原来的颜色,二氧化硫与硫化氢发生氧化还原反应;
(3)从吸收二氧化硫,防止污染气体排放到大气中分析,结合NaHCO3溶液与二氧化硫的反应是利用亚硫酸酸性强于碳酸进行分析书写;
(4)二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸.
解答:
解:(1)A中使铜与浓硫酸在加热条件下反应生成了二氧化硫气体,通过BC后,由于二氧化硫是大气污染气体,不能排放到大气中,需要进行尾气处理吸收,所以浸氢氧化钠溶液的棉花团是吸收二氧化硫的作用,反应离子方程式为SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O;
(2)二氧化硫通过盛品红的B试管,红色褪去,说明了二氧化硫的漂白性,二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色;试管C中溶液变浑浊是因为发生了反应2H2S+SO2=3S↓+2H2O,反应中二氧化硫做氧化剂,故答案为:溶液由无色变成红色;氧化;
(3)试管C口部的棉团浸NaHCO3溶液,是利用碳酸氢钠溶液的碱性和酸性氧化物二氧化硫反应,吸收污染气体,防止污染大气,反应的化学方程式为2NaHCO3+SO2=Na2SO3+2CO2↑+H2O;
故答案为:吸收有害气体,防止污染空气;2NaHCO3+SO2=Na2SO3+2CO2↑+H2O;
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,
故答案为:NH3、Cl2、O3、ClO2中的任意两种或其他合理气体.
(2)二氧化硫通过盛品红的B试管,红色褪去,说明了二氧化硫的漂白性,二氧化硫的漂白作用是二氧化硫生成的亚硫酸与品红结合成不稳定的无色物质,加热会恢复红色;试管C中溶液变浑浊是因为发生了反应2H2S+SO2=3S↓+2H2O,反应中二氧化硫做氧化剂,故答案为:溶液由无色变成红色;氧化;
(3)试管C口部的棉团浸NaHCO3溶液,是利用碳酸氢钠溶液的碱性和酸性氧化物二氧化硫反应,吸收污染气体,防止污染大气,反应的化学方程式为2NaHCO3+SO2=Na2SO3+2CO2↑+H2O;
故答案为:吸收有害气体,防止污染空气;2NaHCO3+SO2=Na2SO3+2CO2↑+H2O;
(4)将B试管换成D试管,并从直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,
故答案为:NH3、Cl2、O3、ClO2中的任意两种或其他合理气体.
点评:本题考查了物质性质实验方案的设计,侧重于浓硫酸与铜反应,二氧化硫的漂白性、氧化性的实验验证、污染气体的实验处理,二氧化硫的还原性和酸性氧化物的性质应用,信息应用能力,离子方程式的书写方法,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A、离子半径:Z>Y>X |
| B、最高正价氧化物对应的水化物的酸性:R<W |
| C、X与Z组成的化合物是共价化合物,且又具有两性 |
| D、R的单质能与W的氢化物反应,可证明非金属性:R>W |
用铝热法还原下列化合物,制得金属各1mol,需消耗铝最少的是( )
| A、MnO2 |
| B、WO3 |
| C、Fe3O4 |
| D、Cr2O3 |
两种气态烃以任意比例混合,在115℃时1L该混合烃与9LO2混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中符合此条件的是 ( )
| A、CH4、C2H4 |
| B、CH4、C3H6 |
| C、C2H2、C3H4 |
| D、C2H2、C3H6 |


 中含氧官能团的名称是
中含氧官能团的名称是