题目内容
下列物质中,含有离子键的化合物是( )
| A、KOH |
| B、H2O |
| C、HCl |
| D、H2 |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族(H元素除外)、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答:
解:A.KOH中钾离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,属于离子化合物,故A正确;
B.水分子中H原子和O原子之间只存在共价键,属于共价化合物,故B错误;
C.HCl分子中H原子和Cl原子之间只存在共价键,是共价化合物,故C错误;
D.氢气分子中H原子之间只存在共价键,属于单质,故D错误;
故选A.
B.水分子中H原子和O原子之间只存在共价键,属于共价化合物,故B错误;
C.HCl分子中H原子和Cl原子之间只存在共价键,是共价化合物,故C错误;
D.氢气分子中H原子之间只存在共价键,属于单质,故D错误;
故选A.
点评:本题考查了基本概念,明确单质和化合物、物质中存在的化学键即可解答,注意离子化合物中可能含有共价键,题目难度不大.

练习册系列答案
相关题目
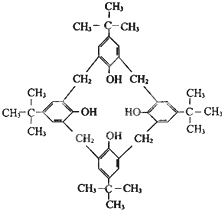 杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )
杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )| A、分子式是C40H54O4 |
| B、既能发生氧化反应,也与氢氧化钠溶液反应 |
| C、至少有9个碳原子在同一个平面上 |
D、可由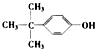 与HCHO缩合而成 与HCHO缩合而成 |
在0.5mol Na2CO3中,含有( )
| A、0.5mol CO32- |
| B、0.5mol Na+ |
| C、6.02×1023个C |
| D、3.01×1023个O |
pH=3的CH3COOH、H2SO4、HNO3、HCl溶液中,分别加入足量的Zn粉,当三种溶液的体积相同时,下列说法正确的是( )
| A、CH3COOH放出的H2最多 |
| B、HNO3中放出的H2最多 |
| C、H2SO4放出的H2最多 |
| D、HCl,HNO3放出的H2最多 |
500m L 1mol?L-1某溶液中,所含溶质的质量为20g,则该溶质的摩尔质量为( )
| A、20 g?mol-1 |
| B、30 g?mol-1 |
| C、40 g?mol-1 |
| D、60 g?mol-1 |
下列叙述正确的是( )
| A、室温下,将pH=2 H2SO4与pH=12 NH3?H2O溶液等体积混合后,混合液pH<7 |
| B、室温下,将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混合液13<pH<14 |
| C、室温下,将pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7 |
| D、某温度下水的离子积为1×10-12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比 为1:10 |
下列说法正确的是( )
| A、1mol氧 |
| B、SO42-的摩尔质量是96g/mol |
| C、3mol小麦 |
| D、摩尔质量就是物质的相对分子质量 |