题目内容
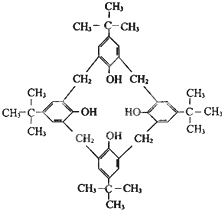 杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )
杯芳烃因分子形状与希腊圣杯相似而得名,对“特丁基杯芳烃”的结构简式如图所示,下列说法不正确的是( )| A、分子式是C40H54O4 |
| B、既能发生氧化反应,也与氢氧化钠溶液反应 |
| C、至少有9个碳原子在同一个平面上 |
D、可由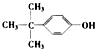 与HCHO缩合而成 与HCHO缩合而成 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:每个C形成4个化学键,由结构简式可知分子式,分子中含有酚羟基,可发生氧化和显色反应,结合结构解答该题.
解答:
解:A.每个C形成4个化学键,由结构简式可知分子式为C44H5604,故A错误;
B.分子中含有酚羟基,则既能发生氧化反应,也与氢氧化钠溶液反应,故B正确;
C.与苯环直接相连的原子共平面,则至少有9个碳原子在同一个平面上,故C正确;
D.由酚醛树脂的合成可知,可由 与HCHO缩合而成,故D正确.
与HCHO缩合而成,故D正确.
故选A.
B.分子中含有酚羟基,则既能发生氧化反应,也与氢氧化钠溶液反应,故B正确;
C.与苯环直接相连的原子共平面,则至少有9个碳原子在同一个平面上,故C正确;
D.由酚醛树脂的合成可知,可由
 与HCHO缩合而成,故D正确.
与HCHO缩合而成,故D正确.故选A.
点评:本题考查有机物的结构与性质,为高频考点,把握有机物结构的对称性为解答的关键,侧重分析能力及结构对称性考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);(正反应为吸热反应),当达到平衡后,t0时升高温度,下列说法正确的是( )
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |
下列叙述不正确的是( )
| A、苯与氢气反应属于加成反应 |
| B、苯与硝酸的反应是加成反应 |
| C、苯与液溴生成溴苯 |
| D、苯能够萃取溴水中的溴 |
下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A、C3H6和C3H8 |
| B、C2H6O和C2H4 |
| C、C5H8和C6H6 |
| D、C2H6和C3H8 |
下列物质中,含有离子键的化合物是( )
| A、KOH |
| B、H2O |
| C、HCl |
| D、H2 |
下列有关物质的性质或应用的说法正确的是( )
| A、石油裂化可获得乙烯、丙烯和丁二烯 |
| B、石油裂解的目的主要是为了得到更多的汽油 |
| C、盐析可用于提纯蛋白质并保持其生理活性 |
| D、木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
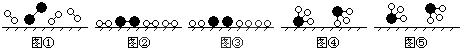
 、
、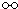 、
、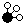 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是