题目内容
在0.5mol Na2CO3中,含有( )
| A、0.5mol CO32- |
| B、0.5mol Na+ |
| C、6.02×1023个C |
| D、3.01×1023个O |
考点:物质的量的相关计算
专题:计算题
分析:A、利用碳酸钠与碳酸根离子的关系式计算钠离子的含量;
B、利用碳酸钠与钠离子的关系式计算钠离子的含量;
C、利用碳酸钠与碳原子的关系计算碳原子的个数;
D、利用碳酸钠与氧原子的关系计算氧原子的个数.
B、利用碳酸钠与钠离子的关系式计算钠离子的含量;
C、利用碳酸钠与碳原子的关系计算碳原子的个数;
D、利用碳酸钠与氧原子的关系计算氧原子的个数.
解答:
解:A、在0.5molNa2CO3中,碳酸根离子和碳酸钠的物质的量是相等的,含有的碳酸根离子物质的量是0.5mol,故A正确;
B、在0.5molNa2CO3中,含有钠离子的物质的量是1mol,故B错误;
C、在0.5mol的碳酸钠中含有碳原子的物质的量是0.5mol,个数是3.01×1023个,故C错误;
D、在0.5mol的碳酸钠中含有氧原子的物质的量是1.5mol,个数是1.806×1024个,故D错误.
故选A.
B、在0.5molNa2CO3中,含有钠离子的物质的量是1mol,故B错误;
C、在0.5mol的碳酸钠中含有碳原子的物质的量是0.5mol,个数是3.01×1023个,故C错误;
D、在0.5mol的碳酸钠中含有氧原子的物质的量是1.5mol,个数是1.806×1024个,故D错误.
故选A.
点评:本题考查学生物质的量和微粒数之间的换算关系知识,注意知识的归纳和梳理是关键,难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列叙述不正确的是( )
| A、苯与氢气反应属于加成反应 |
| B、苯与硝酸的反应是加成反应 |
| C、苯与液溴生成溴苯 |
| D、苯能够萃取溴水中的溴 |
下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A、C3H6和C3H8 |
| B、C2H6O和C2H4 |
| C、C5H8和C6H6 |
| D、C2H6和C3H8 |
下列有机物检验方法正确的是( )
| A、取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 |
| B、淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,来检验葡萄糖 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、用新制CaO检验乙醇中是否含有水分 |
下列物质中,含有离子键的化合物是( )
| A、KOH |
| B、H2O |
| C、HCl |
| D、H2 |
把11克金属混合物加入足量的稀H2SO4中,在标准状况下产生0.5mol气体,则混合物中所含的金属可能是( )
| A、Al和Mg |
| B、Al和Zn |
| C、Zn和Fe |
| D、Fe和Mg |
在水中水分子可彼此通过氢键形成(H2O)n的小集团.在一定温度下(H2O)n的n=5,每个水分子被4个水分子包围着形成四面体.(H2O)n的n=5时,下列说法中正确的是( )
| A、(H2O)n是一种新的水分子 |
| B、(H2O)n仍保留着水的化学性质 |
| C、1 mol(H2O)n中有2个氢键 |
| D、1 mol(H2O)n中有4 mol氢键 |
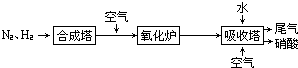
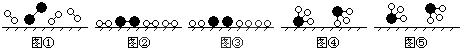
 、
、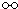 、
、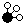 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是