题目内容
9.单晶硅是制作电子集成电路的基础材料.科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高.用化学方法可制得高纯度硅,其化学方程式为:①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO
②Si+2Cl2$\frac{\underline{\;点燃\;}}{\;}$SiCl4
③SiCl4+2H2$\frac{\underline{\;\;△\;\;}}{\;}$Si+4HCl.
回答下列问题:
(1)上述反应中,属于氧化还原反应的是①②③(填序号).
(2)反应①和③属于C.
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)下列描述正确的是B.
A.氧化还原反应都是置换反应
B.判断一个反应是否为氧化还原反应的依据是否有化合价的升降
C.化合反应全部都是氧化还原反应
D.复分解反应全部都是氧化还原反应.
分析 (1)有化合价变化的反应是氧化还原反应;
(2)一种单质和一种化合物反应生成锌的单质和化合物的反应是置换反应;
(3)根据氧化还原反应和四大基本反应类型之间的关系来回答.
解答 解:(1)反应①②③中有化合价变化的元素,该反应是氧化还原反应,故答案为:①②③;
(2)反应①和③是一种单质和一种化合物反应生成新的单质和化合物的反应,是置换反应,故选C;
(3)A.氧化还原反应不一定为置换反应,置换反应均为氧化后还原反应,故A错误;
B.氧化还原反应的特征是有化合价的升降,故B正确;
C.部分化合反应是氧化还原反应,如氧化钙和水的反应,为化合反应,但不是氧化还原反应,故C错误;
D.复分解反应元素化合价没有发生变化,全部都是非氧化还原反应,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握氧化还原反应的反应的特点,难度不大,注意相关基础知识的积累.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
19.将物质的量均为a mol的钠和铝一同投入m g足量的水中,所得溶液的密度为ρ g/cm3,则此溶液的物质的量浓度为( )
| A. | $\frac{1000aρ}{(50a+m)}$ mol/L | B. | $\frac{aρ}{(46a+m)}$ mol/L | ||
| C. | $\frac{1000aρ}{(46a+m)}$ mol/L | D. | $\frac{1000aρ}{(47a+m)}$ mol/L |
17.原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为1、5、6、1.a-的电子层结构与氦相同,b和c的次外层电子数与电子层数相同,c2-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素b、c的离子半径大小为:c<b | |
| B. | a和b、c均能形成电子数为18的分子 | |
| C. | 元素a、b、c各自最高和最低化合价的代数和分别为0、2、4 | |
| D. | d和其他3种元素均能形成离子化合物 |
4.某强酸性无色透明溶液中,可大量共存的离子组是( )
| A. | Na+、HCO3-、SO42-、Br- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Na+、Cu2+、SO42-、NO3- | D. | Na+、Ba2+、Cl-、SO42- |
14.用石墨电极电解下列溶液,阴极和阳极产生气体的体积比为2:1,其电解液pH不变的是( )
| A. | NaCl | B. | H2SO4 | C. | NaOH | D. | K2SO4 |
1.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 0.1mol•L-1 稀硫酸中含有SO42-离子个数为0.1NA | |
| B. | 0.1molNa2O2与CO2完全反应,转移电子数为0.2 NA | |
| C. | 常温常压下,46 g的NO2和46g 的N2O4含有的原子数相等 | |
| D. | 标准状况下,22.4L SO3所含的分子数为NA |
 的键线式是
的键线式是
 所示.请写出其结构简式
所示.请写出其结构简式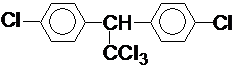
 进行命名,它的名称是2-甲基-3-乙基已烷
进行命名,它的名称是2-甲基-3-乙基已烷 的一氯取代物有2 种.
的一氯取代物有2 种.