题目内容
14.CH4和CO2可以制造价值更高的化学产品.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ•mol-1
则反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
| A. | a+2b-c | B. | a+b-2c | C. | 2a+2b-c | D. | a+2b-2c |
分析 根据盖斯定律,利用已知热化学方程式构建目标热化学方程式,反应热与化学计量数成正比.
解答 解:已知①CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
③2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
据盖斯定律,①+2×②-2×③得:CH4(g)+CO2(g)?CO(g)+2H2(g)△H=(a+2b-2c)kJ/mol,
故选D.
点评 本题考查反应热的计算,熟练应用盖斯定律是解答关键,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
9.下列物质间的转化不能通过一步反应完成的是( )
| A. | SiO2→Si | B. | SiO2→H2SiO3 | C. | Si→Na2SiO3 | D. | CO2→C |
19.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
6.电子表和电子计算机的电源通常用微型银-锌电池,其电极分别为Ag2O、Zn,电解质为KOH溶液,电极总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中正确的是( )
| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
3.W、X、Y、Z均为短周期元素,W-的电子层结构与氦相同,X、Y处在同一周期,X、Y的原子最外层电子数分别为1、6,Z原子的L电子层有7个电子,下列说法正确的是( )
| A. | 单质沸点:W>Z | |
| B. | 离子半径:Y2->Z- | |
| C. | 原子序数:Z>Y>X>W | |
| D. | W分别与Y、Z形成的化合物中均只含极性共价键 |
8.下列实验操作中错误的是( )
| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 蒸发操作时,不能使蒸发皿中的水分完全蒸干后才停止加热 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
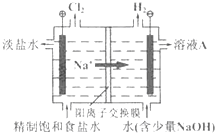 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
 .
.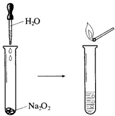 Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.
Na2O2具有强氧化性,可以用来漂白纺织类物品、麦杆、纤维等.