题目内容
6.电子表和电子计算机的电源通常用微型银-锌电池,其电极分别为Ag2O、Zn,电解质为KOH溶液,电极总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中正确的是( )| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
分析 根据电池反应式Ag2O+Zn=2Ag+ZnO知,失电子的物质作负极,得电子的物质作正极,原电池放电时,阳离子移向正极,根据电池电极附近氢离子或氢氧根离子浓度的变化判断溶液pH值的变化.
解答 解:A、电池反应式Ag2O+Zn=2Ag+ZnO中,较活泼的金属锌锌作负极,Ag2O是正极,故A错误;
B、电池反应式Ag2O+Zn=2Ag+ZnO中,失电子的物质Zn作负极,碱性环境下,负极反应为Zn+2OH--2e-=Zn(OH)2,故B正确;
C、极反应为Zn+2OH--2e-=Zn(OH)2,工作时负极区溶液的pH减小,故C错误;
D、原电池中,阳离子移向正极,所以溶液中K+移向正极,故D错误.
故选B.
点评 本题考查了原电池原理,难度不大,明确原电池正负极的判断方法、电极附近离子浓度的变化导致溶液pH值的变化即可解答本题.

练习册系列答案
相关题目
16.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
14.CH4和CO2可以制造价值更高的化学产品.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ•mol-1
则反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=a kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=b kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=c kJ•mol-1
则反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H用含a、b、c的代数式表示为( )
| A. | a+2b-c | B. | a+b-2c | C. | 2a+2b-c | D. | a+2b-2c |
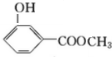
11.如图是合成一种香料过程的中间产物,下列关于该物质的说法不正确的是( )
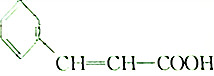
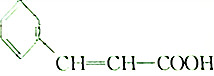
| A. | 该物质能与Na发生反应生成H2 | B. | 该物质能发生加聚反应 | ||
| C. | 该物质在一定件下可发生酯化反应 | D. | 物质的摩尔质量为148 |
18.熟石灰的溶解度随温度变化的曲线如图所示,下列说法正确的是( )
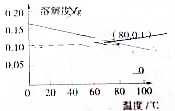

| A. | 熟石灰的溶解是吸热过程 | |
| B. | 温度升高时熟石灰的熔解速率减慢 | |
| C. | 80℃时,熟石灰的Ksp约等于9.8×10-6 | |
| D. | 若硝酸钾中含有少量的熟石灰,可用溶解、过滤的方法进行提纯 |
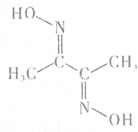 铁、钴、镍等金属及其化合物在工业上有重要用途.请回答:
铁、钴、镍等金属及其化合物在工业上有重要用途.请回答: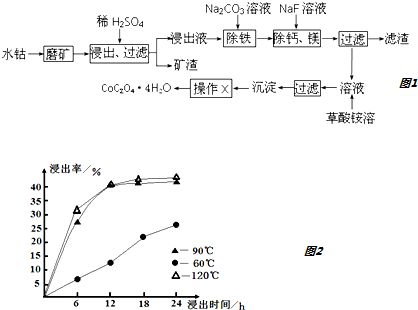
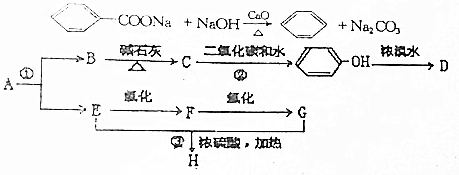
 ;化合物H的名称甲酸甲酯.
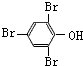
;化合物H的名称甲酸甲酯.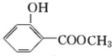 ,
, .
.