题目内容
5.常温下,a mL pH=2的H2SO4溶液与b mL pH=12的氨水溶液混合,充分反应.①混合前,两溶液中由水电离出的H+浓度之比为1:1;
②若a=b,则反应后溶液显碱性(填“酸性”、“中性”或“碱性”).
分析 ①两溶液都抑制了水的电离,硫酸中氢氧根离子、氨水中氢离子是水电离的,据此计算出混合前两溶液中由水电离出的H+浓度之比;
②一水合氨为弱碱,两溶液等体积混合后氨水过量,混合液呈碱性.
解答 解:①常温下pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,硫酸电离的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,则硫酸中水电离的氢离子浓度为$\frac{1×1{0}^{-14}}{1×1{0}^{-2}}$mol/L=1×10-12mol/L;pH=12的氨水抑制了水的电离,溶液中氢离子是水电离的,则氨水中水电离的氢离子为1×10-12mol/L,所以混合前两溶液中由水电离出的H+浓度之比=1×10-12mol/L:1×10-12mol/L=1:1,
故答案为:1:1;
②若a=b,由于一水合氨为弱碱,氨水浓度大于0.01mol/L,则混合液中氨水过量,反应后溶液显示碱性,
故答案为:碱性.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核外最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应.下列说法不正确的是( )
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:W<Z<X | |
| C. | Z与W、Y形成的化合物中,其化学键类型不相同 | |
| D. | 最高价氧化物的水化物的酸性:W<Z |
10.下列叙述正确的是( )
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 屠呦呦利用乙醇萃取青蒿汁中的青蒿素,获得了2015年度诺贝尔医学奖,为人类防治疟疾作出了重大贡献 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 |
17.比较1mol N2和1mol CO的下列物理量:①质量 ②分子总数 ③原子总数 ④体积,其中一定相同的是( )
| A. | ① | B. | ①② | C. | ①②③ | D. | ②③④ |
14.下列基团表示方法正确的是( )
| A. | 乙基 CH2CH3 | B. | 硝基-NO3 | C. | 苯基 | D. | 羟基  |
15.pH=1的盐酸与pH=12的NaOH溶液混合,要使溶液呈中性.盐酸与NaOH溶液的体积比为( )
| A. | 1:10 | B. | 1:20 | C. | 5:1 | D. | 10:1 |




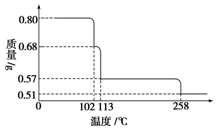 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.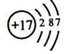 .
.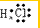 ;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为
;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为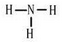 ,四种元素对应的化学性质最稳定的单质的电子式为
,四种元素对应的化学性质最稳定的单质的电子式为 .
.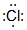 →
→ .
.