题目内容
盐酸、硫酸、硝酸都是重要的化工原料,也是化学实验室必备的重要试剂:
(1)常温下可用铁、铝的容器盛装浓硫酸,说明浓硫酸具有 性;
(2)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标况下的体积可能是
A 40.32L B 32.24L C 20.16L D 13.44L
(3)若使(2)的反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 .
(1)常温下可用铁、铝的容器盛装浓硫酸,说明浓硫酸具有
(2)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标况下的体积可能是
A 40.32L B 32.24L C 20.16L D 13.44L
(3)若使(2)的反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式
考点:浓硫酸的性质,硝酸的化学性质
专题:元素及其化合物
分析:(1)常温下,浓硫酸和铁、铝易发生钝化现象;
(2)Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,浓硫酸和Cu反应但稀硫酸和Cu不反应,据此计算生成气体体积;
(3)加入硝酸钠后,酸性条件下,硝酸根离子和铜发生氧化还原反应.
(2)Cu+2H2SO4(浓)
| ||
(3)加入硝酸钠后,酸性条件下,硝酸根离子和铜发生氧化还原反应.
解答:
解:(1)常温下,浓硫酸和Fe、Cu反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,该反应中浓硫酸体现强氧化性,
故答案为:强氧化性;
(2)Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,浓硫酸和Cu反应但稀硫酸和Cu不反应,浓硫酸的物质的量=18mol/L×0.1L=1.8mol,根据方程式知,如果浓硫酸完全反应,有一半的浓硫酸被还原,实际上当浓硫酸浓度降低到一定程度时,硫酸和铜不反应,所以小于一半的浓硫酸被还原,其物质的量小于0.9mol,则生成二氧化硫的物质的量小于0.9mol,其体积<0.9mol×22.4L/mol=13.44L,故选D;
(3)加入硝酸钠后,酸性条件下,硝酸根离子和铜发生氧化还原反应生成铜离子、NO和水,离子方程式为3Cu+8H ++2NO3-=3Cu 2++2NO↑+4H2O,
故答案为:3Cu+8H ++2NO3-=3Cu 2++2NO↑+4H2O.
故答案为:强氧化性;
(2)Cu+2H2SO4(浓)
| ||
(3)加入硝酸钠后,酸性条件下,硝酸根离子和铜发生氧化还原反应生成铜离子、NO和水,离子方程式为3Cu+8H ++2NO3-=3Cu 2++2NO↑+4H2O,
故答案为:3Cu+8H ++2NO3-=3Cu 2++2NO↑+4H2O.
点评:本题考查了浓硫酸、硝酸的性质,涉及物质的量的计算、离子方程式的书写等知识点,知道浓硫酸有三大性质,注意稀硫酸和不活泼金属不反应,注意(3)中酸性条件下,硝酸根离子的性质,为易错点.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
对于反应,CaH2+2H2O═Ca(OH)2+2H2↑的以下叙述中,错误的是( )
| A、H2既是氧化产物又是还原产物 |
| B、CaH2中的氢元素即被氧化又被还原 |
| C、反应中水为氧化剂 |
| D、氧化产物与还原产物的物质的量之比为1:1 |


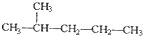 和
和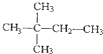 ②
② 和
和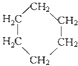
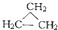 ④C2H6和
④C2H6和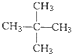 ⑤
⑤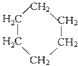 和
和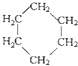
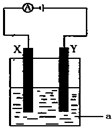 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是