题目内容
在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),按要求填空:若所得混合气体中H2的相对密度为d,则混合气体的物质的量为 ,NH4HCO3的摩尔质量为 (用含m、d的代数式表示)
考点:物质的量的相关计算
专题:计算题
分析:根据质量守恒定律,混合气体总质量等于碳酸氢铵的质量,根据相对密度计算混合气体平均摩尔质量,再根据n=
计算混合气体的物质的量;根据方程式:NH4HCO3
NH3↑+CO2↑+H2O(g),计算碳酸氢铵的物质的量,根据M=
计算NH4HCO3的摩尔质量.
| m |
| M |
| ||
| m |
| n |
解答:
解:根据质量守恒定律,混合气体总质量等于碳酸氢铵的质量,混合气体中H2的相对密度为d,则混合气体的摩尔质量为2dg/mol,故混合气体的物质的量为
=
mol,
根据方程式:NH4HCO3
NH3↑+CO2↑+H2O(g),可知碳酸氢铵的物质的量为
×
mol,则NH4HCO3的摩尔质量为
=6d g/mol,
故答案为:
mol;6d g/mol.
| mg |
| 2dg/mol |
| m |
| 2d |
根据方程式:NH4HCO3
| ||
| 1 |
| 3 |
| m |
| 2d |
| mg | ||||
|
故答案为:
| m |
| 2d |
点评:本题考查物质的量有关计算,难度不大,侧重对基础知识的理解巩固.

练习册系列答案
相关题目
在下列物质分类中,前者包括后者的是( )
| A、金属氧化物 化合物 |
| B、溶液 胶体 |
| C、电解质 化合物 |
| D、混合物 胶体 |
假定C2H6与Cl2发生取代反应时,各种产物均可能生成,则生成物最多有( )
| A、8种 | B、9种 |
| C、10种 | D、11种 |
2013年12月15日,嫦娥三号着陆器与巡视器分离,“玉兔号”巡视器顺利驶抵月球表面.“玉兔”号是中国首辆月球车,成功实现对月面的科学探测.“玉兔”号用
Pu作为热源材料.下列关于
Pu的说法正确的是( )
238 94 |
238 94 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
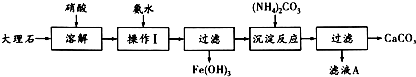
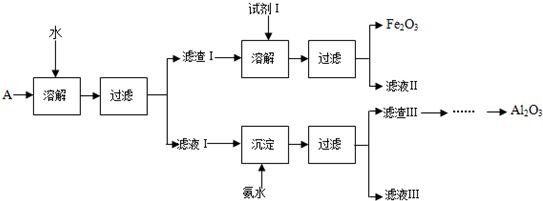
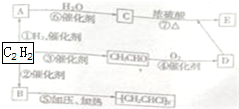 有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题:
有机物A、B、C、D、E能发生如图所示的转化,其中C、D是生活中常见的有机物,E是具有特殊香味且不溶于水的液体.请回答下面有关问题: