题目内容
16. 如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.
如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.(1)写出下列物质的化学式.
A:Na2O2 B:Na2CO3 C:Na E:NaOH
(2)写出下列转化的化学方程式:
C→A:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2
C→E:2Na+2H2O=2NaOH+H2↑
A→B:2Na2O2+2CO2=2Na2CO3+O2
(3)把淡黄色固体A投入酚酞溶液中的现象为产生气泡,无色溶液先变为红色,后褪色.
分析 A为淡黄色固体,能与CO2、水反应,则A是Na2O2,C是金属单质,与氧气反应得到A,故C为Na,过氧化钠与水、Na与水反应都得到E,则E为NaOH,C能与氯气反应得到D为NaCl,A和二氧化碳反应生成Na2CO3和O2,B能转化为NaCl,则B是Na2CO3,据此解答.
解答 解:A为淡黄色固体,能与CO2、水反应,则A是Na2O2,C是金属单质,与氧气反应得到A,故C为Na,过氧化钠与水、Na与水反应都得到E,则E为NaOH,C能与氯气反应得到D为NaCl,A和二氧化碳反应生成Na2CO3和O2,B能转化为NaCl,则B是Na2CO3.
(1)由上述分析可知,A为Na2O2,B为Na2CO3,C为Na,E为NaOH,
故答案为:Na2O2;Na2CO3;Na;NaOH;
(1)C→A是钠与氧气在加热条件下反应生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
C→E是钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑;
A→B是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;2Na+2H2O=2NaOH+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(3)把过氧化钠投入酚酞溶液中,过氧化钠与水反应生成氢氧化钠与氧气,产生气泡,溶液变为红色,过氧化钠具有强氧化性,又是溶液红色褪去,故现象为:产生气泡,无色溶液先变为红色,后褪色,
故答案为:产生气泡,无色溶液先变为红色,后褪色.
点评 本题考查无机物的推断,侧重于钠及其化合物之间的转化,根据A的颜色及其特殊的反应来分析解答,熟练掌握元素化合物性质,题目难度不大.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案| A. | 16mol | B. | 18mol | C. | 20mol | D. | 24mol |
| A. | c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) | B. | c(Na+)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | ||
| C. | c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3) | D. | c(Na+)>c(SO32-)>c(OH-)>c(HSO3-) |
| A. | Ca2+Cl- CO32- | B. | Na+ Ba2+ Cl- | ||
| C. | Na+ SO42- Ba2+ | D. | H+ NO3- OH- |
| A. | 氢氧化钠溶液吸收过量的二氧化碳:OH-+CO2═HCO3- | |
| B. | 亚硫酸氢铵溶液与足量氢氧化钠溶液反应:HSO3-+OH-═SO32-+H2O | |
| C. | 氯气通入冷水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
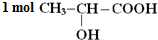 分别与Na、NaOH、NaHCO3完全反应时,消耗的Na、NaOH、NaHCO3的物质的量之比为2:1:1,写出该有机物和NaOH反应的化学方程式CH3CH(OH)COOH+NaOH→CH3CH(OH)COONa+H2O.
分别与Na、NaOH、NaHCO3完全反应时,消耗的Na、NaOH、NaHCO3的物质的量之比为2:1:1,写出该有机物和NaOH反应的化学方程式CH3CH(OH)COOH+NaOH→CH3CH(OH)COONa+H2O.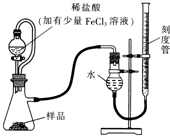 过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
过氧化镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.
 .
. .
.