题目内容
6.一种比黄金贵百倍的18O2气体,不久前在兰州近代物理研究所制备成功.1mol18O2气体中所含中子的物质的量为( )| A. | 16mol | B. | 18mol | C. | 20mol | D. | 24mol |
分析 18O2分子中,氧元素的质量数为18,氧元素的质子数为8,则该氧原子的中子数=质量数-质子数=18-8=10,据此可计算出1mol18O2气体中所含中子的物质的量.
解答 解:18O2分子中,氧元素的质量数为18,氧元素的质子数为8,则该氧原子的中子数=质量数-质子数=18-8=10,
1mol18O2气体中含有2mol18O,所含中子的物质的量为20mol,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确质量数与质子数、中子数的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法不正确的是( )
| A. | 量取10.08 mL 0.1 mol•L-1 NaHCO3溶液用碱式滴定管量取 | |
| B. | 为测定新制氯水的 pH,用玻璃棒蘸取液体滴在 pH 试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对 H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知 4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1 KI 溶液、0.1 mol•L-1 稀硫酸外,还需要用到淀粉溶液 |
7.某温度下,关于浓度相等的盐酸和醋酸溶液,下列说法正确的是( )
| A. | pH HCl>CH3COOH | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 | |
| D. | 用同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,消耗的NaOH溶液体积一样多 |
4.适当可以加热,只用一种试剂就可以鉴别的物质组是( )
| A. | NaCl、KNO3、AlCl3、Fe(NO3)3 | B. | Fe、FeO、CuO、FeS、CuS、MnO2 | ||
| C. | MgCl2、FeCl2、KCl、AlCl3、NH4Cl | D. | K2CO3、NaI、Na2CO3、NaCl、Na2SO4 |
1.在200mL含Mg2+、Al3+、NH+4、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )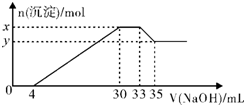

| A. | 原溶液的pH=l | B. | 原溶液中n(Mg2+):n(Al3+)=5:2 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.825mol/L |
11.NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 高温下60gSiO2与足量纯碱反应,最多释放出2NA个气体分子 | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |
15.有关下列物质分子结构特征描述正确的是( )
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. | 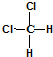 和 和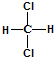 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
 如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.
如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.