题目内容
11.下列各组离子,能在溶液中大量共存的是( )| A. | Ca2+Cl- CO32- | B. | Na+ Ba2+ Cl- | ||
| C. | Na+ SO42- Ba2+ | D. | H+ NO3- OH- |
分析 A.钙离子与碳酸根离子反应生成碳酸钙沉淀;
B.三种离子之间不发生反应,能够共存;
C.硫酸根离子与钡离子反应生成难溶物硫酸钡;
D.氢离子与氢氧根离子发生中和反应.
解答 解:A.Ca2+、CO32-之间反应生成碳酸钙,在溶液中不能大量共存,故A错误;
B.Na+、Ba2+、Cl-之间不反应,在溶液中能够大量共存,故B正确;
C.SO42-、Ba2+之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故C错误;
D.H+、OH-之间发生中和反应,在溶液中大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
1.在200mL含Mg2+、Al3+、NH+4、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )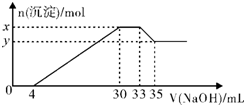

| A. | 原溶液的pH=l | B. | 原溶液中n(Mg2+):n(Al3+)=5:2 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.825mol/L |
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| B. | 17g羟基中含有的电子数为10NA | |
| C. | 标准状况下,1mol已烷中共价键数目为19NA | |
| D. | 1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和小于0.1NA |
19.某种烃与H21:1加成后的产物如图, 则该烃的结构式可能有( )
则该烃的结构式可能有( )
 则该烃的结构式可能有( )
则该烃的结构式可能有( )| A. | 1种 | B. | 3种 | C. | 2种 | D. | 4种 |
6.如果你家里的食用花生油混有水分,你将采用下列何种方法分离( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 蒸发 |
 如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.
如图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为金属单质,D为最常用的调味品.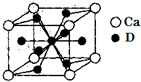 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: