题目内容
1.下列物质中,含有非极性共价键的离子化合物是( )| A. | Na2O2 | B. | CO2 | C. | NaOH | D. | H2O2 |
分析 一般来说,活泼金属与非金属形成离子键,同种非金属之间形成非极性共价键,含离子键的一定为离子化合物,以此来解答.
解答 解:A.含离子键和O-O非极性共价键,为离子化合物,故A选;
B.只含C=O极性共价键,故B不选;
C.含离子键和O-H极性共价键,故C不选;
D.含H-O、O-O共价键,不含离子键,故D不选;
故选A.
点评 本题考查离子化合物及化学键,为高频考点,把握化学键的形成及判断一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
11.把VL含有硫酸镁和硫酸铝的混合溶液分成两等份,一份加入含有amol氢氧化钠溶液,恰好使铝离子完全转化为偏铝酸根离子(1mol铝离子消耗4摩尔氢氧化钠生成1摩尔偏铝酸根离子);另一份加入含有bmol氯化钡溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中镁离子的浓度为( )
| A. | $\frac{8b-3a}{2v}$mol/L | B. | $\frac{8b-3a}{4v}$mol/L | C. | $\frac{8b-3a}{v}$mol/L | D. | $\frac{a-2b}{2v}$mol/L |
9.下列化学用语正确的是( )
| A. | CO2的电子式: | B. | Mg2+的结构示意图: | ||
| C. | Na2O的电子式: | D. | N2的电子式: |
16.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 液溴和液汞的汽化 |
6.某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素不可能具有的性质是( )
| A. | 在周期表中处于第3周期 VIIA | B. | 在周期表中处于第2周期VA族 | ||
| C. | 氢化物比PH3稳定 | D. | 常见化合价有-3、+2、+3、+5价 |
6.在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是( )
| A. | 溶液中有晶体析出,Na+数目不变 | |
| B. | 溶液中的OH- 物质的量浓度不变,有O2放出 | |
| C. | 溶质的质量分数增大 | |
| D. | 溶液中NaOH的浓度减小,有O2放出 |
 可简写为
可简写为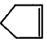 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: