题目内容
12.下列说法正确的是( )| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 反应2NO2(g)?N2O4(g)△H<O,升高温度该反应平衡常数增大 |
分析 A.平衡常数只与温度有关,温度不变,平衡常数不变,转化率增大,不一定是改变温度;
B.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大;
C.碳酸氢钠和氢氧化钠反应生成碳酸钠;
D.反应是放热反应,升温平衡向吸热反应方向进行;
解答 解:A.平衡常数只与温度有关,温度不变,平衡常数不变,转化率增大,不一定是改变温度使平衡向正反应移动,故转化率增大,平衡常数不一定增大,故A错误;
B.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,则V1>V2,故B错误;
C.碳酸氢钠和氢氧化钠反应生成碳酸钠,NaHCO3+NaOH=Na2CO3+H2O,Na+和CO32-的离子浓度均增大,故C正确;
D.反应2NO2(g)?N2O4(g)△H<O,升高温度平衡逆向进行,该反应平衡常数减小,故D错误;
故选C.
点评 本题考查了电解质的电离、盐类的水解以及平衡影响因素的分析、酸碱反应后溶液酸碱性判断等知识点,注意平衡常数随温度变化,题目难度中等.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
7.下列物质的主要成分和光导纤维的成分不同的是( )
| A. | 水晶 | B. | 玛瑙 | C. | 石英 | D. | 计算机芯片 |
8.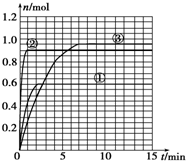 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
(1)体系中发生反应的化学方程式是2X+2Y?2Z+W;
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
5.X、Y、Z三种元素原子序数依次增大,X与Z同主族,Y与Z同周期,Z的单质通常为黄绿色气体,Z与Y能形成YA型化合物,下列说法正确的是( )
| A. | 在元素周期表中,Y所在族的元素都是活泼金属元素 | |
| B. | 37Z原子核电子数为20 | |
| C. | X与Y能形成YX型化合物 | |
| D. | 在常温下,Z的单质与氢气一定能大量共存 |
17.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH试纸呈红色的溶液:Na+、K+、Fe3+、NO3- |
2.下图中能组成原电池产生电流的是( )
| A. | 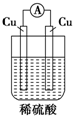 | B. | 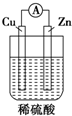 | C. | 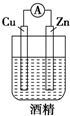 | D. | 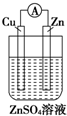 |
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.