题目内容
17.在下列给定条件的溶液中,一定能大量共存的离子组是( )| A. | 无色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH试纸呈红色的溶液:Na+、K+、Fe3+、NO3- |
分析 A.Cu2+为蓝色;
B.NaAlO2溶液,显碱性;
C.离子之间相互促进水解;
D.能使pH试纸呈红色的溶液,显酸性.
解答 解:A.Cu2+为蓝色,与无色不符,且H+、SiO32-结合生成沉淀不能共存,故A错误;
B.NaAlO2溶液,显碱性,不能大量存在H+,且H+、CO32-结合生成水和气体不能共存,故B错误;
C.Al3+、HCO3-相互促进水解,不能大量共存,故C错误;
D.能使pH试纸呈红色的溶液,显酸性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
12.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、MnO4-、Mg2+、SO42- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Zn2+、Al3+、NO3-、Cl- | D. | Na+、Fe2+、NO3-、SO42- |
13.向含有下列各离子组的溶液中通入足量相应气体后,各离子还能大量存在的是( )
| A. | 二氧化碳:K+、Na+、SiO32-、Cl- | B. | 氨气:Ag+、Al3+、Na+、NO3- | ||
| C. | 氯化氢:Ca2+、Fe3+、NO3-、Cl- | D. | 氯气:Na+、Ba2+、I-、HSO3- |
12.下列说法正确的是( )
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 常温下,V1L pH=12的NaOH溶液与V2L pH=2的HA溶液混合,若混合液显中性,则V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固体,Na+和CO32-的离子浓度均增大 | |
| D. | 反应2NO2(g)?N2O4(g)△H<O,升高温度该反应平衡常数增大 |
9.下面有关化学反应速率和限度的图象和实验结论表达均正确的是( )
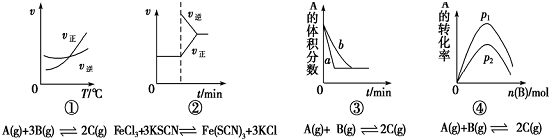

| A. | 图①是其他条件一定时反应速率随温度变化的图象,图象表明,较低温度下升温平衡逆向移动,较高温度下升温平衡正向移 | |
| B. | 图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化 | |
| C. | 图③可能是催化剂对化学平衡的影响,也可能是其它因素对化学平衡的影响 | |
| D. | 图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
7.利用图装置进行实验,甲乙两池均为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+浓度越大,氧化性越强).
下列说法不正确的是( )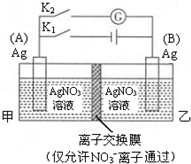
下列说法不正确的是( )

| A. | 闭合K1,断开K2后,A电极增重 | |
| B. | 闭合K1,断开K2后,乙池溶液中Ag+浓度增大 | |
| C. | 断开K1,闭合K2后,B电极发生氧化反应 | |
| D. | 断开K1,闭合K2后,NO3-向A电极移动 |
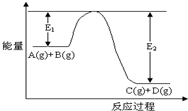 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题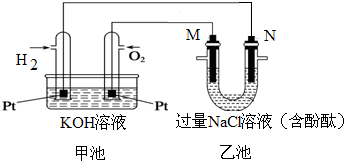 如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题:
如图所示是氢氧燃料电池工作时的装置,乙池中的两个电极均是石墨电极,请回答下列问题: