��Ŀ����
��1����һ�ڿ����б�¶����KOH���壬������֪�京ˮ2.8%����K2CO337.3%������ΪKOH����ȡ1g��Ʒ���뵽25mL 2mol?L-1�������У�����������1.0mol?L-1 KOH��Һ33.9mLǡ����ȫ�кͣ������кͺ���Һ�ɵõ����� g������������ȷ��С�����3λ��
��2�������������������15g�У�����ϡ����150mL���ܷų�H2 1.68L����״������ͬʱ��������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯��Ϊ���к�����H2SO4����ʹFe2+��ȫת����Fe��OH��2��������3mol?L-1��NaOH��Һ200mL����ԭ��������ʵ���Ũ���� mol/L
��3��V L Fe2��SO4��3��Һ�к���a g
��ȡ����Һ0.5V L����ˮϡ����2V L����ϡ�ͺ���Һ�� Fe3+�����ʵ�����Ũ��Ϊ mol/L ���������������ʽ��
��4��������ѧ�ҽ�Ǧ�������Ԫ�ص�ԭ�Ӻ˶�ײ�������һ��������Ϊ118��������Ϊ293����Ԫ�أ���ԭ��ԭ�Ӻ����������ͺ��������֮��Ϊ ��
��5���ڻ�ѧ��ӦaZn+bHNO3��ϡ���TcZn��NO3��2+dNO��+eH2O�У���e��ֵΪ4����d��ֵΪ ��
��2�������������������15g�У�����ϡ����150mL���ܷų�H2 1.68L����״������ͬʱ��������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯��Ϊ���к�����H2SO4����ʹFe2+��ȫת����Fe��OH��2��������3mol?L-1��NaOH��Һ200mL����ԭ��������ʵ���Ũ����
��3��V L Fe2��SO4��3��Һ�к���a g
| SO | 2- 4 |
��4��������ѧ�ҽ�Ǧ�������Ԫ�ص�ԭ�Ӻ˶�ײ�������һ��������Ϊ118��������Ϊ293����Ԫ�أ���ԭ��ԭ�Ӻ����������ͺ��������֮��Ϊ
��5���ڻ�ѧ��ӦaZn+bHNO3��ϡ���TcZn��NO3��2+dNO��+eH2O�У���e��ֵΪ4����d��ֵΪ
���㣺��ѧ����ʽ���йؼ���,���ʵ���Ũ�ȵ���ؼ���,������ԭ��Ӧ����ʽ����ƽ
ר�⣺������
��������1��K2CO3��KOH�����ᷴӦ�IJ��ﶼ��KCl�������������KOH��Һ�պ��кͣ����ȫ������KCl���������õ��Ĺ���ΪKCl��������Ԫ���غ㣬���������ʵ���Ũ�ȼ���KCl�����ʵ������Դ˼����������������
��2����������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯����Ԫ���ڷ�Ӧ�����Һ����Fe2+��ʽ���ڣ�Ϊ���к��������ᣬ����ʹ����ȫת����Fe��OH��2��������3mol/L��NaOH��Һ200mL��˵����Ӧ�����Һ����ֻ��Na2SO4������������غ㣬��n��H2SO4��=n��Na2SO4���������������غ㣬��n��Na2SO4��=
n��NaOH�����ݴ˼����ԭ������Һ����������ʵ���������������������ʵ���Ũ�ȣ�
��3������n=
����ag SO42-�����ʵ�������������0.5L��Һ��n��SO42-������ϻ�ѧʽ����0.5L��Һ��n��Fe3+�����ٸ���c=
����ϡ�ͺ�Fe3+�����ʵ���Ũ�ȣ�
��4��������=������+���������ݴ˼��������������������=�������������������ͺ��������֮�
��5�����ݵ���ת���غ��֪2a=3d���ٽ��ԭ���غ���
��2����������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯����Ԫ���ڷ�Ӧ�����Һ����Fe2+��ʽ���ڣ�Ϊ���к��������ᣬ����ʹ����ȫת����Fe��OH��2��������3mol/L��NaOH��Һ200mL��˵����Ӧ�����Һ����ֻ��Na2SO4������������غ㣬��n��H2SO4��=n��Na2SO4���������������غ㣬��n��Na2SO4��=
| 1 |
| 2 |
��3������n=
| m |
| M |
| n |
| V |
��4��������=������+���������ݴ˼��������������������=�������������������ͺ��������֮�
��5�����ݵ���ת���غ��֪2a=3d���ٽ��ԭ���غ���
���
�⣺��1��K2CO3��KOH�����ᷴӦ�IJ��ﶼ��KCl�������������1.0mol/LKOH��Һ�պ��кͣ����ȫ������KCl���������õ��Ĺ���ΪKCl������ClԪ���غ�ɵã�n��KCl��=n��HCl��=0.025L��2mol/L=0.05mol������m��KCl��=0.05mol��74.5g/mol=3.725g��
�ʴ�Ϊ��3.725��
��2����������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯����Ԫ���ڷ�Ӧ�����Һ����Fe2+��ʽ���ڣ�Ϊ���к��������ᣬ����ʹ����ȫת����Fe��OH��2��������3mol/L��NaOH��Һ200mL��˵����Ӧ�����Һ����ֻ��Na2SO4������������غ㣬��n��H2SO4��=n��Na2SO4���������������غ㣬��n��Na2SO4��=
n��NaOH��������n��H2SO4��=n��Na2SO4��=
n��NaOH��=
��3mol/L��0.2L=0.3mol��c��H2SO4��=
=2mol/L��
�ʴ�Ϊ��2��
��3��ag SO42-�����ʵ���=
=
mol��0.5L��Һ��n��SO42-��=
mol��
=
mol��0.5L��Һ��n��Fe3+��=
n��SO42-��=
mol��
����ϡ�ͺ�Fe3+�����ʵ���Ũ��=
=
mol/L��
�ʴ�Ϊ��
��
��4��һ��������Ϊ118��������Ϊ293����Ԫ�أ���ԭ��������=293-118=175���ʸ�ԭ��ԭ�Ӻ����������ͺ��������֮��Ϊ175-118=57��
�ʴ�Ϊ��57��
��5�����ݵ���ת���غ��֪2a=3d������Znԭ���غ�a=c������Hԭ���غ�b=2e=8������Nԭ���غ㣺b=2c+d����8=3d+d����d=2��
�ʴ�Ϊ��2��
�ʴ�Ϊ��3.725��
��2����������������ʣ�࣬��Ӧ�����Һ�е���KSCN��Һ��δ����ɫ�仯����Ԫ���ڷ�Ӧ�����Һ����Fe2+��ʽ���ڣ�Ϊ���к��������ᣬ����ʹ����ȫת����Fe��OH��2��������3mol/L��NaOH��Һ200mL��˵����Ӧ�����Һ����ֻ��Na2SO4������������غ㣬��n��H2SO4��=n��Na2SO4���������������غ㣬��n��Na2SO4��=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.3mol |
| 0.15L |
�ʴ�Ϊ��2��
��3��ag SO42-�����ʵ���=
| ag |
| 96g/mol |
| a |
| 96 |
| a |
| 96 |
| 0.5L |
| 1L |
| a |
| 192 |
| 2 |
| 3 |
| a |
| 192 |
| 2 |
| 3 |
| ||||
| 2VL |
| a |
| 576V |
�ʴ�Ϊ��
| a |
| 576V |
��4��һ��������Ϊ118��������Ϊ293����Ԫ�أ���ԭ��������=293-118=175���ʸ�ԭ��ԭ�Ӻ����������ͺ��������֮��Ϊ175-118=57��
�ʴ�Ϊ��57��
��5�����ݵ���ת���غ��֪2a=3d������Znԭ���غ�a=c������Hԭ���غ�b=2e=8������Nԭ���غ㣺b=2c+d����8=3d+d����d=2��
�ʴ�Ϊ��2��
���������⿼�黯ѧ���㣬����ƴ������Ŀ���漰�������㡢���ʵ���Ũ�ȡ�ԭ�ӽṹ����ѧ����ʽ����ȣ���1����2����ע�������غ�˼����㣬���ؿ���ѧ������˼ά�����Ŀ��飬�Ѷ��еȣ�

��ϰ��ϵ�д�
 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
�����Ŀ
��NA���������ӵ�������������Ȼ�ѧ����ʽ C2H2��g��+
O2��g����2CO2��g��+H2O��l����H=-1300kJ/mol��˵���У���ȷ���ǣ�������
| 5 |
| 2 |
| A����10NA������ת��ʱ���÷�Ӧ�ų�1300kJ������ |
| B����1NA��ˮ����������ΪҺ��ʱ������1300kJ������ |
| C����2NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |
| D����6NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |
�Ѣ�pH��ͬ�İ�ˮ������������Һ �����ʵ���Ũ����ͬ�Ĵ�������ᣬ�ֱ��ˮϡ����ͬ������pH�ϴ���ǣ�������
| A����������������Һ�ϴ�������ϴ� |
| B�����а�ˮ�ϴ�������ϴ� |
| C�����а�ˮ�ϴ��д���ϴ� |
| D����������������Һ�ϴ��д���ϴ� |
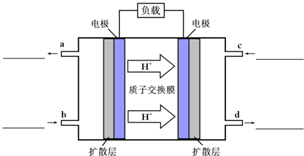 �״�-����ȼ�ϵ�أ�DMFC����һ�ָ�Ч�ܡ�����Ⱦ�綯�����ij��ص�أ���ȼ�ϵ�صĵ�ط�ӦʽΪ��CH3OH��l��+
�״�-����ȼ�ϵ�أ�DMFC����һ�ָ�Ч�ܡ�����Ⱦ�綯�����ij��ص�أ���ȼ�ϵ�صĵ�ط�ӦʽΪ��CH3OH��l��+
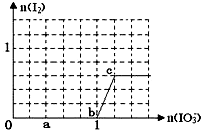 ��֪��Һ�У���ԭ��HSO3-��I-��������IO3-��I2��SO42-���ں�3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ���Իش��������⣺
��֪��Һ�У���ԭ��HSO3-��I-��������IO3-��I2��SO42-���ں�3molNaHSO3����Һ����μ���KIO3��Һ�������KIO3��������I2�����ʵ����Ĺ�ϵ��������ͼ��ʾ���Իش��������⣺