题目内容
7.如图为元素周期表的一部分,下列有关短周期元素X,Y,Z,R的叙述正确的是( )
| A. | 热稳定性:Y的气态氢化物>Z的气态氢化物 | |
| B. | Z的最高价氧化物对应水化物的分子式为H2ZO4 | |
| C. | X元素的单质能与所有强酸发生反应放出H2 | |
| D. | R的核外电子数与OH-的核外电子数相同 |
分析 根据元素在周期表中的位置知,X、Y、Z、R分别是Al、C、O、Ne元素,
A.元素的非金属性越强,其氢化物的稳定性越强;
B.Z是O元素,没有最高价氧化物的水化物;
C.X为Al,和弱氧化性酸反应生成氢气,和强氧化性酸反应不生成氢气;
D.R为Ne元素,其原子核外有10个电子,OH-核外有10电子.
解答 解:根据元素在周期表中的位置知,X、Y、Z、R分别是Al、C、O、Ne元素,
A.元素的非金属性越强,其氢化物的稳定性越强,非金属性Z>Y,所以热稳定性:Y的气态氢化物<Z的气态氢化物,故A错误;
B.Z是O元素,没有最高价氧化物的水化物,故B错误;
C.X为Al,和弱氧化性酸反应生成氢气,和强氧化性酸反应不生成氢气,如和浓硝酸反应生成二氧化硫、和硝酸反应生成氮氧化物,故C错误;
D.R为Ne元素,其原子核外有10个电子,OH-核外有10电子,所以R的核外电子数与OH-的核外电子数相同,故D正确;
故选D.
点评 本题考查原子结构和元素周期律的关系,为高频考点,侧重考查学生分析判断能力,明确元素周期律、物质结构和性质是解本题关键,知道阴阳离子核外电子数的计算方法,为易错点.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
18.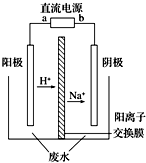 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
 最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法--隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 电解过程中,阴极区消耗Na+ | |
| B. | 阳极反应为CH3CHO-2e-+2H+═CH3COOH+H2O | |
| C. | 电解的总反应方程式为2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3COOH+CH3CH2OH | |
| D. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 |
15.对实验①中和滴定;②中和热的测定;③实验室制备乙烯;④实验室用自来水制蒸馏水.下列叙述不正确的是( )
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
2.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
12.下列叙述中正确的是( )
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两中性原子一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
19.下列能说明碳与氮两元素非金属性相对强弱的是( )
| A. | 相同条件下水溶液的pH:Na2CO3>Na2SO4 | |
| B. | 酸性:H2SO3>H2CO3 | |
| C. | CH4比NH3更稳定 | |
| D. | C与H2的化合价比N2与H2的化合更容易 |
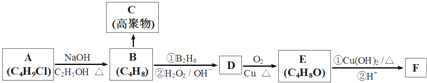
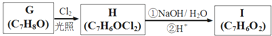
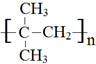 ,
,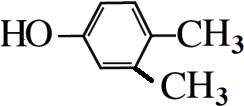 .
.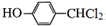 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaCl+2H2O.
+2NaCl+2H2O.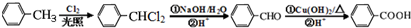 .
.