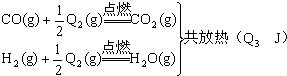题目内容
10.在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是H2,质量最大的是H2O,体积最小的是H2O.分析 依据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$,进行解答.
解答 解:4g氢气的物质的量n(H2)=$\frac{4g}{2g/mol}$=2mol,含有原子数为4NA;标况下体积为:2mol×22.4L/mol=44.8L;
11.2L氧气的物质的量n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5 mol,含有原子数为0.5mol×2×NA=NA;质量为0.5mol×32g/mol=16g;
1mol H2O含有原子数为1mol×3×NA=3NA;质量为1mol×18g/mol=18g;标况下体积V=$\frac{18g}{1g/mL}$=18mL;
依据N=n×NA,分子个数与物质的量成正比,所以在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是:4g H2;
含原子数最多的是:4g H2;体积最小的是:H2O;
故答案为:H2; H2O; H2O.
点评 本题考查了物质的量的有关计算,明确n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$,即可解答,题目难度不大,侧重考查学生对基础知识掌握熟练程度,注意标况下水是液体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.中和相同体积、相同pH的硫酸、盐酸和醋酸三种稀溶液,所用相同浓度的NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系为( )
| A. | V3>V2>V1 | B. | V3=V2>V1 | C. | V3>V2=V1 | D. | V1=V2>V3 |
2.下列属于氧化还原反应的是( )
| A. | MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓ | B. | CO2+2NaOH═Na2CO3+H2O | ||
| C. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | H2+CuO $\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu |