题目内容
17.下列叙述正确的是( )| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
分析 A、失电子化合价升高;
B、氯气与氢氧化钠反应生成氯化钠和次氯酸钠,氯气既是氧化剂又是还原剂;
C、化学反应中,当有电子得失或偏移时,发生氧化还原反应,为氧化还原反应的实质;
D、氧化还原反应中可能部分元素的化合价变化.
解答 解:A、失电子化合价升高,而不是降低,故A错误;
B、氯气与氢氧化钠反应生成氯化钠和次氯酸钠,氯气既是氧化剂又是还原剂,所以在一个氧化还原反应中,氧化剂和还原剂可能是同一物质,故B错误;
C、化学反应中,当有电子得失或偏移时,发生氧化还原反应,为氧化还原反应的实质,故C正确;
D、氧化还原反应中可能部分元素的化合价变化,如氯气与水的反应中只有Cl元素的化合价变化,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意结合实例解答,题目难度不大.

练习册系列答案
相关题目
8.关于C (s)+H2O (g)?CO (g)+H2(g)的平衡常数书写形式,正确的是( )
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
5.X、Y、Z、W都是短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X、Y、Z三种原子的最外层电子数之和为19.下列说法正确的是( )
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
12.${\;}_{\;}^{16}$O和${\;}_{\;}^{18}$O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2是氧元素的两种核素 | |
| B. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| C. | 通过化学变化可以实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间的相互转化 | |
| D. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O核外电子排布方式不同 |
2.短周期元素A、B、C、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
(1)R元素在周期表的位置是第三周期IVA族,化合物DT中存在的化学键是离子键.
(2)写出E单质与NaOH溶液反应的离子方程式2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)1g B2A4完全燃烧,恢复到常温时放出a kJ的热量,写出B2A4完全燃烧的热化学方程式C2H4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-28a kJ/mol;B2A4形成高分子的化学方程式n C2H4$\stackrel{一定条件}{→}$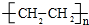 .
.
(4)RT4极易水解生成两种酸,写出该反应的化学方程式SiCl4+4H2O=H4SiO4↓+4HCl.
(5)工业上用A元素的单质、C元素的单质合成化合物,此反应的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}(N{H}_{3})}$;为了提高合成效率,常采用的方法有采取高温高压、使用催化剂.
(6)D的过氧化物的电子式为 ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
(7)工业上电解饱和DT水溶液的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(2)写出E单质与NaOH溶液反应的离子方程式2Al+2H2O+2OH-═2AlO2-+3H2↑.
(3)1g B2A4完全燃烧,恢复到常温时放出a kJ的热量,写出B2A4完全燃烧的热化学方程式C2H4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-28a kJ/mol;B2A4形成高分子的化学方程式n C2H4$\stackrel{一定条件}{→}$
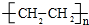 .
.(4)RT4极易水解生成两种酸,写出该反应的化学方程式SiCl4+4H2O=H4SiO4↓+4HCl.
(5)工业上用A元素的单质、C元素的单质合成化合物,此反应的平衡常数表达式为$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}(N{H}_{3})}$;为了提高合成效率,常采用的方法有采取高温高压、使用催化剂.
(6)D的过氧化物的电子式为
 ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.(7)工业上电解饱和DT水溶液的离子方程式为2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑.
6.为检验某卤代烃(R-X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却.正确操作的先后顺序是( )
| A. | ③①⑤⑥②④ | B. | ③①②⑥④⑤ | C. | ③⑤①⑥④② | D. | ③⑤①⑥②④ |
7.已知反应:3A+4B?C+2D 其反应速率可以分别用V(A)、V(B)、V(C)、V(D)[mol/(L•min)]表示,则正确的关系是( )
| A. | V(A)=$\frac{1}{3}$V(C) | B. | V(B)=$\frac{4}{3}$V(A) | C. | V(C)=4V(B) | D. | V(D)=2V(C) |