题目内容
某氮的氧化物和CO在催化剂的作用下充分反应,生成氮气和CO2,若测得氮气和CO2的物质的量之比为1:2,则该氮的氧化物是( )
| A、N2O |
| B、N2O5 |
| C、NO2 |
| D、NO |
考点:化学方程式的有关计算
专题:计算题
分析:在氧化还原反应中氧化剂和还原剂得失电子数目相等,表现为化合价升降的总数相等,据此计算氧化剂中N元素化合价,据此解答.
解答:
解:反应后N2和CO2的物质的量之比为1:2,设氮的氧化物中N元素的化合价为x,氧化还原反应中氧化剂和还原剂得失电子数目相等,则:
2×1×(x-0)=2×(4-2),
解得x=2,应为NO,
故选D.
2×1×(x-0)=2×(4-2),
解得x=2,应为NO,
故选D.
点评:本题考查氧化还原反应知识,题目难度不大,注意从化合价升降数值总数相等的角度列式计算.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是( )
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
下列说法正确的是( )
| A、某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3?H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| C、0.1 mol?L HA(一元酸)溶液与0.1mol?L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(A-) |
| D、常温下0.4 mol/L HA溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)>c(H+)>c(Na+)>c(OH-) |
“1998中国十大科技成果”之一是合成一维纳米氮化镓,已知镓是ⅢA族元素,则氮化镓的化学式可能是( )
| A、Ga3N2 |
| B、Ga2N3 |
| C、GaN |
| D、Ga3N |
下列实验能达到目的是( )
A、 证明酸性:盐酸>碳酸>苯酚 |
B、 石油蒸馏 |
C、 实验室制硝基苯 |
D、 实验室制乙酸乙酯 |
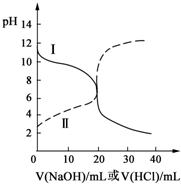 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
设NA代表阿伏加德罗常数.下列叙述正确的是( )
| A、标准状况下2.24 L H2O中,分子数为0.1NA |
| B、1 L 0.5mol?L-1 AlCl3溶液中含有的Al3+数为0.5 NA |
| C、常温常压下16g O2中,氧原子数为NA |
| D、0.1mol 铁粉与足量的盐酸充分反应,转移的电子数为0.3NA |