题目内容
白钨矿的主要成分是CaWO4,含有二氧化硅、氧化铁等杂质,工业生产钨流程如下:
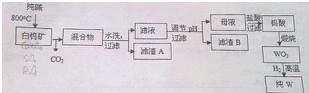
(完全沉淀离子的pH值,SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是 ,CaWO4与纯碱发生的化学反应方程式是 .
(2)滤渣A的主要成分是(写化学式) ,滤渣B的化学式是 .

(完全沉淀离子的pH值,SiO32-为8,WO42-为5)
(1)白钨矿反应前需要进行粉碎,其目的是
(2)滤渣A的主要成分是(写化学式)
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:白钨矿中加入纯碱,在加热到800℃时焙烧发生CaWO4+Na2CO3
Na2WO4+CaO+CO2↑、SiO2+Na2CO3
Na2SiO3+CO2↑,水洗、过滤得到的滤渣主要为Fe2O3,滤液中含有Na2WO4、Na2SiO3,调节pH,得到沉淀B为H2SiO3,母液中含有Na2WO4,加入盐酸生成H2WO4,煅烧后分解生成WO3,用氢气还原可生成W,以此解答该题.
| ||
| ||
解答:
解:白钨矿中加入纯碱,在加热到800℃时焙烧发生CaWO4+Na2CO3
Na2WO4+CaO+CO2↑、SiO2+Na2CO3
Na2SiO3+CO2↑,水洗、过滤得到的滤渣主要为Fe2O3,滤液中含有Na2WO4、Na2SiO3,调节pH,得到沉淀B为H2SiO3,母液中含有Na2WO4,加入盐酸生成H2WO4,煅烧后分解生成WO3,用氢气还原可生成W,
(1)白钨矿反应前需要进行粉碎,可增大接触的表面加,增大反应速率,CaWO4与纯碱发生的化学反应方程式是CaWO4+Na2CO3
Na2WO4+CaO+CO2↑,
故答案为:增大接触面积,加快反应速率;CaWO4+Na2CO3
Na2WO4+CaO+CO2↑;
(2)氧化铁与纯碱不反应,则滤渣A为Fe2O3,由以上分析可知滤渣B为 H2SiO3,故答案为:Fe2O3; H2SiO3.
| ||
| ||
(1)白钨矿反应前需要进行粉碎,可增大接触的表面加,增大反应速率,CaWO4与纯碱发生的化学反应方程式是CaWO4+Na2CO3
| ||
故答案为:增大接触面积,加快反应速率;CaWO4+Na2CO3
| ||
(2)氧化铁与纯碱不反应,则滤渣A为Fe2O3,由以上分析可知滤渣B为 H2SiO3,故答案为:Fe2O3; H2SiO3.
点评:本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,主要把握实验的原理和流程,为解答该题的关键,难度不大.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O |
| B、碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH -=CaCO3↓+2H2O+CO32- |
| C、苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O=C6H5OH+CO32- |
| D、稀硝酸与过量的铁屑反应 3Fe+8H++2 NO3-=3Fe 3++2NO↑+4H2O |
室温下反应速率最慢的是 ( )
| A、H2+F2═2HF |
| B、H2+Br2═2HBr |
| C、Ag++Cl-═AgCl |
| D、H++OH-═H2O |
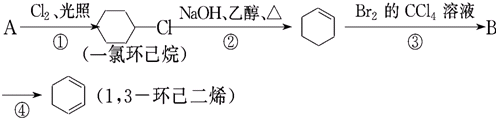
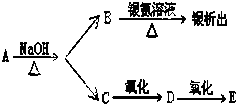 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.