题目内容
6. 同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )
同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )| A. | T1>T2,△H>0 | B. | T1<T2,△H>0 | C. | T1>T2,△H<0 | D. | T1<T2,△H<0 |
分析 由图象可知,T1条件下到达平衡所用时间较少,则T1>T2,根据温度升高A的物质的量分数的变化判断反应热.
解答 解:由图象可知,T1条件下到达平衡所用时间较少,则T1>T2,
升高温度A的物质的量分数增大,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,
故选C.
点评 本题考查化学平衡移动的图象问题,题目难度不大,注意根据达到平衡的时间判断温度的高低,结合温度对平衡移动的影响进一步判断反应热.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
12.下列反应中,可以用离子方程式“H++OH-═H2O”表示的是( )
| A. | NaOH+HCl | B. | Ba(OH)2+H2SO4 | C. | Fe(OH)3+HNO3 | D. | KOH+H2CO3 |
13.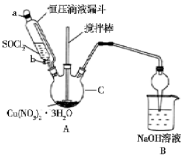 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
(1)铜与稀HNO3反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题(I)以含铁的铜屑为原料制备Cu ( NO3 ) 2•3H2O的实验过程如下:
铜屑(含铁)$→_{步骤Ⅰ}^{稀过量HNO_{3}}$溶液Ⅰ$→_{步骤Ⅱ}^{加入X}$溶液II…→Cu(NO3)2•3H2O
已知几种离子生物生成氢氧化物沉淀的pH如表
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(2)请补充完整由溶液I制备Cu ( NO3 ) 2•3H2O晶体的实验方案:
①往溶液I中加入物质x,调节溶液的pH,其中物质X的化学式为:CuO或Cu(OH)2或Cu2(OH)2CO3,调节溶液的pH范围为:3.2≤pH<4.7,若加入的物质X太少,溶液II中会含有较多的杂质离子,检验溶液II中含有较多该杂
质离子的实验操作方法是:取少量溶液II于试管中,滴入几滴KSCN溶液,若溶液变红,则证明溶液II中含有较多杂质离子
②溶液II经过蒸发浓缩、冷却结晶,过滤,用冰水洗涤,干燥得到
Cu ( NO3 ) 2•3H2O晶体.
(II)用Cu ( NO3 ) 2•3H2O晶体和SOC12制备无水Cu ( NO3 ) 2的实验装置(夹持及控提装置省略)如图所示,已知SOC12熔点为-105℃,沸点为76℃,遇水剧烈水解生成两种酸性气体:
(1)①仪器c的名称是:三颈烧瓶.
②装置A中使用恒压滴液漏斗的优点是:维持滴液漏斗内部与三颈烧瓶中气体压强相等,便于溶液顺利滴下
(2)装置A中Cu ( NO3 ) 2•3H2O晶体和SOC12在加热条件下发生反应的化学方程式是:Cu(NO3)2•3H2O+3SOC12$\frac{\underline{\;\;△\;\;}}{\;}$Cu(NO3)2+3SO2↑+6HCl↑.
10.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
则相关判断正确的是( )
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的原子最外层有3个电子 |
| W | W的一种核素的质量数为28,中子数为14 |
| A. | W原子半径大于Z | |
| B. | 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键 | |
| C. | 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象 | |
| D. | W的单质与氢氟酸反应生成两种无色气体 |
1.实验室从溴水中提取溴单质的操作,正确的是( )
| A. | 分液、蒸馏 | B. | 过滤、蒸发 | C. | 萃取、分液、蒸馏 | D. | 萃取、分液 |
18.下列说法正确的是( )
| A. | FeO、ClO2、SO2都属于氧化物 | |
| B. | 液氯、铁单质、液态氯化氢都属于电解质 | |
| C. | 能发生丁达尔效应的分散系有NaCl溶液、水、蛋白质溶液等 | |
| D. | 除去氢氧化铁胶体中的Na+和Cl-可用过滤的方法 |
16.对下列化学反应热现象,不正确的说法是( )
| A. | 放热的反应,不必加热就能发生反应 | |
| B. | 化学反应一定有能量变化 | |
| C. | 化学反应中,吸热反应不一定需要加热也能发生 | |
| D. | 热化学反应方程式中,热效应数值与反应物的物质的量的多少有关 |