题目内容
在800℃下的密闭容器中存在如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),回答下列问题:
(1)已知CO 和H2O的起始浓度为1mol/L和3mol/L,平衡时测得c(H2)=0.75mol/L,此时H2O的转化率为 .
(2)若反应物的起始浓度c(CO)=amol/L,c(H2O)=15mo/L,达平衡状态时,c(H2)=2.5mol/L,则a= mo/L.
(3)当CO的和H2O的起始浓度相同时,达平衡后,CO的转化率为 .
(1)已知CO 和H2O的起始浓度为1mol/L和3mol/L,平衡时测得c(H2)=0.75mol/L,此时H2O的转化率为
(2)若反应物的起始浓度c(CO)=amol/L,c(H2O)=15mo/L,达平衡状态时,c(H2)=2.5mol/L,则a=
(3)当CO的和H2O的起始浓度相同时,达平衡后,CO的转化率为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)列出三段式,转化率=
×100%;
(2)依据(1)计算平衡常数,结合平衡三段式计算平衡浓度,利用平衡常数计算a值;
(3)依据(1)计算平衡常数,结合平衡三段式计算.
| 消耗量 |
| 起始量 |
(2)依据(1)计算平衡常数,结合平衡三段式计算平衡浓度,利用平衡常数计算a值;
(3)依据(1)计算平衡常数,结合平衡三段式计算.
解答:
解:(1)依据三段式列式计算
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 0.75 0.75 0.75
平衡量(mol/L) 0.25 2.25 0.75 0.75
H2O的转化率=
×100%=25%;
故答案为:25%;
(2)上述反应前后气体体积不变,可以用物质的量代替平衡浓度计算平衡常数K=
=1;
若反应物的起始浓度c(CO)=amol/L,c(H2O)=15mo/L,达平衡状态时,c(H2)=2.5mol/L,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) a 15 0 0
变化量(mol/L) 2.5 2.5 2.5 2.5
平衡量(mol/L) a-2.5 12.5 2.5 2.5
=1
则a=3mol/L;
故答案为:3;
(3)依据三段式列式计算,起始浓度设为m,设一氧化碳消耗浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) m m 0 0
变化量(mol/L) x x x x
平衡量(mol/L) m-x m-x x x
=1
m=2x
CO的转化率=
×100%=50%
故答案为:50%.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 0.75 0.75 0.75
平衡量(mol/L) 0.25 2.25 0.75 0.75
H2O的转化率=
| 0.75mol/L |
| 3mol/L |
故答案为:25%;
(2)上述反应前后气体体积不变,可以用物质的量代替平衡浓度计算平衡常数K=
| 0.75×0.75 |
| 0.25×2.25 |
若反应物的起始浓度c(CO)=amol/L,c(H2O)=15mo/L,达平衡状态时,c(H2)=2.5mol/L,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) a 15 0 0
变化量(mol/L) 2.5 2.5 2.5 2.5
平衡量(mol/L) a-2.5 12.5 2.5 2.5
| 2.5×2.5 |
| (a-2.5)×12.5 |
则a=3mol/L;
故答案为:3;
(3)依据三段式列式计算,起始浓度设为m,设一氧化碳消耗浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) m m 0 0
变化量(mol/L) x x x x
平衡量(mol/L) m-x m-x x x
| x2 |
| (m-x)2 |
m=2x
CO的转化率=
| x |
| 2x |
故答案为:50%.
点评:本题考查了化学平衡三段式计算方法,主要是平衡常数、转化率的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列各组中的性质比较,错误的是( )
| A、酸性:H2SiO3<H2SO4<HClO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:HCl>H2S>PH3 |
| D、还原性:F->Cl->Br- |
下列实验可实现鉴别目的是( )
| A、用KOH溶液鉴别SO3(g)和SO2 |
| B、用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
| C、用CO2鉴别NaAlO2溶液和CH3COONa溶液 |
| D、用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |
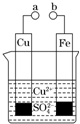 某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )| A、a和b用导线连接时,铁片上发生还原反应 |
| B、a和b不连接时,铁片上会有金属铜析出 |
| C、a和b用导线连接时,电流由a经导线流向b,溶液中SO42-流向Fe电极 |
| D、无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |

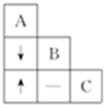 鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.
鉴别失去标签的氯化钡、碳酸钠和稀盐酸三种无色溶液.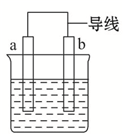 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: