题目内容
11.现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出).
请回答下列问题:
(1)写出下列物质的化学式:B、Al丙HCl
(2)写出物质D的电子式:

(3)气体甲在Cl2中燃烧的现象:有苍白色火焰,瓶口有白雾;
(4)金属A与G的水溶液反应的化学方程式:6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(5)反应③的离子方程式:2OH-+2H2O+2Al=2AlO2-+3H2↑.
分析 金属A与水反应生成气体甲和物质D,D的焰色反应为黄色证明A为Na,则甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生氢气,说明B为Al,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,判断C为Fe,据此答题,
(1)根据上面的分析可知,B为Al,丙为HCl;
(2)氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,氢氧根离子需要标出最外层电子;
(3)氢气在Cl2中燃烧放出苍白色火焰,生成易溶于水的氯化氢气体;
(4)金属A与G的水溶液反应是钠和氯化铁溶液的反应,钠先和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠;
(5)反应③是金属铝和氢氧化钠溶液的反应生成偏铝酸钠和氢气,据此书写离子方程式.
解答 解:金属A与水反应生成气体甲和物质D,D的焰色反应为黄色证明A为Na,则甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生氢气,说明B为Al,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,判断C为Fe,
(1)根据上面的分析可知,B为Al,丙为HCl,
故答案为:Al;HCl;
(2)氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,
,
故答案为: :
:
(3)氢气在Cl2中燃烧的现象为:有苍白色火焰,瓶口有白雾,
故答案为:有苍白色火焰,瓶口有白雾;
(4)金属A与G的水溶液反应的化学方程式:6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑,
故答案为:6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(5)反应③的离子方程式为2OH-+2H2O+2Al=2AlO2-+3H2↑,
故答案为:2OH-+2H2O+2Al=2AlO2-+3H2↑.
点评 本题考查无机物的推断,注意把握焰色反应及物质的颜色为解答本题的突破口,熟悉物质的性质即可解答,题目难度中等.

| A. | 原子及其简单阴离子的核外电子层数都等于该元素所在的周期数 | |
| B. | 原子最外层电子数都等于其所在的族序数 | |
| C. | 元素周期表从ⅢB到ⅡB族共8个纵行,全都是金属元素 | |
| D. | 同周期表中ⅦA族元素的原子半径较小 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
(1)原子半径最小的是H,能形成化合物种类最多的是C.
(2)最高价氧化物对应水化物中,酸性最强的是HClO4,表现两性的是Al(OH)3.以上两种化合物相互反应的离子方程为3H++Al(OH)3=Al3++3H2O.
| A. | 无色溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | 在强酸性的溶液中:Na+、SO42-、Cl-、NH4+ | |
| C. | 使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- | |
| D. | 含SO42-的水溶液中:K+、Ba2+、Cl-、Br- |
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
| A. | 漂白粉、次氯酸溶液和明矾都是混合物 | |
| B. | 不能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 | |
| D. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 |
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |

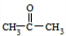 +2H2O;
+2H2O;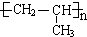 .
.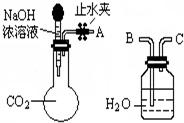 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.