题目内容
6.在下列溶液中,各组离子一定能够大量共存的是( )| A. | 无色溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | 在强酸性的溶液中:Na+、SO42-、Cl-、NH4+ | |
| C. | 使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- | |
| D. | 含SO42-的水溶液中:K+、Ba2+、Cl-、Br- |
分析 A.Fe3+为黄色;
B.强酸溶液中该组离子之间不反应;
B.使紫色石蕊试液变红的溶液,显酸性;
D.离子之间结合生成沉淀.
解答 解:A.Fe3+为黄色,与无色不符,故A错误;
B.强酸溶液中该组离子之间不反应,可大量共存,故B正确;
B.使紫色石蕊试液变红的溶液,显酸性,不能大量存在CO32-,故C错误;
D.SO42-、Ba2+结合生成沉淀,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
14.C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及其化合物的说法中正确的是( )
| A. | 三种元素在自然界中既有游离态又有化合态 | |
| B. | 二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 | |
| C. | 最低价的气态氢化物都具有还原性 | |
| D. | 其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3 |
12.某原电池反应的离子方程式为Zn+Cu2+═Zn2++Cu,关于此原电池,下列说法中正确的是( )
| A. | Cu(NO3)2溶液可作电解质溶液 | |
| B. | 在电解质溶液中,电子由负极流向正极 | |
| C. | 锌极的质量先减小后增大 | |
| D. | 可用镁作正极材料 |
1. 用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
 用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )| A. | 铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为13g | |
| D. | 导线中通过的电子的物质的量为0.2mol |


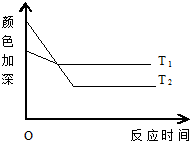 反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):
反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):